
| A. | 与铝反应产生H2的溶液中:Na+、K+、S2-、CO32- | |
| B. | 加入酚酞显红色的溶液中:K+、Na+、Cl-、CH3COO- | |
| C. | pH=2的溶液中:NH4+、Na+、Fe2+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、Al3+ |
分析 A.与铝反应产生H2的溶液中存在大量氢离子或氢氧根离子,硫离子、碳酸根离子与氢离子反应;
B.加入酚酞显红色的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.pH=2的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.水电离出的c(H+)=1×10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,铝离子与氢氧根离子反应.
解答 解:A.与铝反应产生H2的溶液中存在大量氢离子或氢氧根离子,S2-、CO32-与氢离子反应,在酸性溶液中不能大量共存,故A错误;
B.加入酚酞显红色的溶液中存在大量氢氧根离子,K+、Na+、Cl-、CH3COO-之间不反应,都不与氢氧根离子反应,在溶液中不能大量共存,故B正确;
C.pH=2的溶液为酸性溶液,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.水电离出的c(H+)=1×10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,Al3+与氢氧根离子反应,在碱性溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
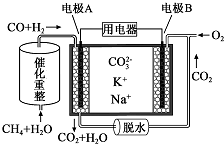
| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质可以与碳酸氢钠反应产生气体 | |
| B. | 该物质可以发生酯化反应 | |
| C. | 此分子应该为某种氨基酸 | |
| D. | 该物质的分子式C3H6O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2作正极,电极发生氧化反应 | |
| B. | 当转移的电子数为3.01×1023时,参与反应的Pb的质量为103.5 g | |
| C. | 负极的电极反应式是:Pb+SO42--2e-═PbSO4 | |
| D. | 溶液中H+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,将0.02 mol•L-1的氨水与a mol•L-1的盐酸等体积混合(体积变化忽略不计),反应后溶液呈中性,则用含a的代数式表示NH3•H2O的电离常数为Kb=$\frac{a×1{0}^{-7}}{0.02-a}$ | |
| B. | 往银氨溶液中加水稀释,反应②平衡向逆反应方向移动 | |
| C. | 若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊 | |
| D. | 已知:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 L 0.1 mol•L-1氨水和足量的盐酸反应放出的热量等于5.73 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 所有的吸热反应一定要在加热的条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、NO3-、ALO2- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
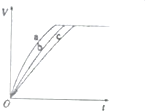 氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.
氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.| 实验编号 | 反应物 |
| a | 10mL2%H2O2溶液、少量烧碱 |
| b | 10mL2%H2O2溶液 |
| c | 10mL2%H2O2溶液、少量盐酸 |
| d | 10mL5%H2O2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com