
(14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知: 2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式 ;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1, c(H2)=0.3mol·L-1;
合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H< 0
2NH3(g) △H< 0
①计算在a达平衡时H2的转化率为 ;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是 ; 试写出判断b与a条件不同的理由 ;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如 下表:
T/(K) | 298 | 398 | 498 | …… |
K | 4.1×106 | K1 | K2 | …… |
①试确定K1的相对大小,K 1 4.1× 106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内NH3的浓度保持不变 B.2υ( N2)正= υ( H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 ) 。
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y = 14, x > 11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-) D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(14分)
(1) 4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=-(2b+c-2a)kJ·mol-1(2分)
(或 4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=(2a-2b-c)kJ·mol-1等)
(2)①40%(2分)
②升高温度(1分);因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以b、a两条件下达到平衡时N2的浓度相同(或其他合理答案)(2分)
(3)<(1分);AC(2分)
(4)①NH4++H2O NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
②BC(2分)
【解析】
试题分析:(1)由图1可知,1mol NO2和1mol CO反应生成CO2和NO的热化学方程式是CO(g)+NO2(g)=CO2(g)+NO(g) △H=-(b-a)kJ/mol,根据盖斯定律,将2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1与上式×2相加,可得CO将NO2还原至N2时的热化学方程式,为4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=-(2b+c-2a)kJ·mol-1;
(2)①在a达平衡时,氮气的浓度减小(0.1-0.06)mol/L=0.04mol/L,则氢气的浓度减小0.04mol/L×3=0.12mol/L,则平衡时 H2的转化率为0.12mol/L/0.3mol/L×100%=40%;
②由图2可知,曲线c达平衡时氮气的浓度增大且达平衡的时间缩短,说明反应速率加快,且平衡逆向移动,因为合成氨是放热反应,所以c改变的条件可能是升高温度,升高温度,平衡逆向移动,反应速率加快;而b达平衡时与a的氮气的浓度相同,达平衡的时间缩短,反应速率加快,说明平衡不移动,则b改变的条件是加入催化剂,所以b与a的条件不同;
(3)①合成氨是放热反应,温度升高,平衡逆向移动,平衡常数减小,所以K1< 4.1× 106;
②A、达平衡时,各物质的浓度均保持不变,所以容器内NH3的浓度保持不变的状态是平衡状态,正确;B、根据化学方程式可知,达平衡时,3υ( N2)正= υ( H2)逆,错误;C、因为合成氨的反应是气体的物质的量发生改变的可逆反应,所以容器的体积固定时,压强不变的状态是平衡状态,正确;D、因为容器的体积不变,气体的总质量不变,所以气体的密度一直不变,所以气体的密度不变的状态不是平衡状态,错误,答案选AC;
(4)①NH4Cl溶液呈酸性的原因是因为铵根离子发生水解反应,使溶液中的氢离子浓度大于氢氧根离子的浓度,离子方程式是NH4++H2O NH3·H2O+H+;
NH3·H2O+H+;
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y = 14, x > 11 )等体积混合后,则氨水溶液中的氢氧根
离子浓度等于硫酸中的氢离子浓度,因为氨水是弱碱溶液,所以等体积混合后,一水合氨过量,溶液
呈碱性,排除BD,得到的溶液为硫酸铵和一水合氨的混合液,则溶液中c(NH4+)>c(SO42-)>c(OH-)>c(H
+)成立;根据电荷守恒规律,有c(NH4+)+c(H+)=2c(SO42-)+c(OH-),c(SO42-)>0,所以c(NH4+)+c(H
+)>c(SO42-)+c(OH-),则答案选BC。
考点:考查盖斯定律的应用,热化学方程式的书写,溶液中离子浓度的判断,化学平衡移动的判断


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
某种聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6===6C+LiCoO2,其电池如图所示。
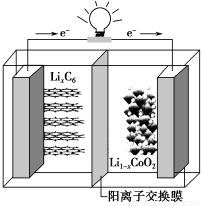
下列说法不正确的是
A.放电时,LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时将电池的负极与外接电源的负极相连
D.放电时,电池的正极反应为Li1-xCoO2+xLi++xe-===LiCoO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、W、Z、R的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2-具有相同的核外电子数,R是同周期中原子半径最小的元素。下列叙述正确的是
A.Y2-的离子半径大于W3+的离子半径
B.Y、Z形成的化合物为离子化合物
C.W的最高价氧化物对应的水化物的酸性比X的强
D.Z的气态简单氢化物的稳定性比R的强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.质子数为92、中子数为143的铀(U)原子: 92235U
B.过氧化氢的电子式: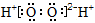
C.氯离子的结构示意图: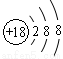
D.1,3—二甲基丁烷:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
200mL 0.1 mol·L-1CH3COOH与200mL 0.1 mol·L-1NaOH溶液混合后,离子浓度关系正确的是
A.c(Na+) = c(CH3COO-)+ c(CH3COOH)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)+ c(OH-)= c(CH3COO-)+ c(H+)
D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体 C.硫酸钠溶液 D.纯碱溶液
II、合成氨的流程示意图如下:

回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是


A.上述气体检测时,敏感电极均作电池正极
B.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测Cl2时,敏感电极的电极反应式为:Cl2 + 2e-= 2Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第一次模拟考试化学试卷(解析版) 题型:选择题
电解质在溶液中的行为是化学研究的重要内容。下列有关溶液的叙述错误的
A.Fe2(SO4)3溶液蒸干、灼烧,得到Fe2O3
B.相同条件下,等物质的量浓度的溶液导电能力:NaOH>CH3COOH
C.溶液中结合质子(氢离子)的能力:CO32―>HCO3―>CH3COO―
D.海洋封存CO2会导致局部海洋水体酸性增强,会破坏海洋生态环境
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com