
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
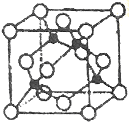
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
【答案】(1)[Ar]3d9(2)正四面体;CCl4等;HClO4有3个非羟基氧,而HClO2有1个非羟基氧;
(3)sp2;11NA(4)A(5)①CuCl;②共价;③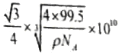
【解析】
试题分析:周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子,R为C元素。工业上通过分离液态空气获得X单质,X为O元素,则W为N元素。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,则Y为Cl元素。Z基态原子的最外能层只有一个电子,其他能层均己充满电子,Z为Cu元素。
(1) Z为Cu元素。铜为29号元素,Z2+基态核外电子排布式为[Ar]3d9,故答案为:[Ar]3d9;
(2) YX4-为ClO4-,其中Cl的孤电子对数目为![]() (7+1-4×2)=0,连接的原子数目为4,采取sp3杂化,空间构型是正四面体;与YX4-互为等电子体的分子有CCl4;HClO4有3个非羟基氧,而HClO2有1个非羟基氧,使得HClO4酸性比HClO2强,故答案为:正四面体;CCl4等;HClO4有3个非羟基氧,而HClO2有1个非羟基氧;
(7+1-4×2)=0,连接的原子数目为4,采取sp3杂化,空间构型是正四面体;与YX4-互为等电子体的分子有CCl4;HClO4有3个非羟基氧,而HClO2有1个非羟基氧,使得HClO4酸性比HClO2强,故答案为:正四面体;CCl4等;HClO4有3个非羟基氧,而HClO2有1个非羟基氧;
(3)结构简式为CO (N2H3)2的结构为![]() ,其中C原子上连接有3个原子,没有孤电子对,采取sp2杂化,lmo1 CO (N2H3)2分子中含有σ键数目为11NA,故答案为:sp2;11NA
,其中C原子上连接有3个原子,没有孤电子对,采取sp2杂化,lmo1 CO (N2H3)2分子中含有σ键数目为11NA,故答案为:sp2;11NA
(4)往硫酸铜溶液中通入过量的NH3,可生成[Cu(NH3)4]SO4,A. [Cu(NH3)4]SO4属于离子化合物,所含的化学键有离子键、硫酸根离子和氨分子中存在极性键和铜离子和N原子间存在配位键,故A正确;B.在[Cu(NH3)4]2+中Cu2+提供空轨道给出孤对电子,NH3给出孤对电子,故B错误;C.在[Cu(NH3)4]SO4组成元素中第一电离能最大的是氮元素,因为氮的2p为半充满结构,故C错误;故选A;
(5)①该晶体中Cu原子数目为4,Cl原子数目为8×![]() +6×
+6×![]() =4,故化学式为CuCl,故答案为:CuCl;
=4,故化学式为CuCl,故答案为:CuCl;
②已知Z和Y的电负性分别为1.9和3.0,电负性的差值为1.1<1.8,则Y与L形成的化合物属于共价化合物,故答案为:共价;
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶胞的边长为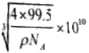 cm,该晶体中Cu原子和Cl原子之间的最短距离为体对角线的
cm,该晶体中Cu原子和Cl原子之间的最短距离为体对角线的![]() ,即
,即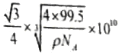 cm,故答案为:
cm,故答案为: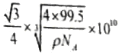 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )
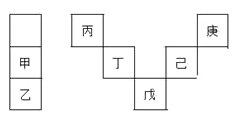
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物为分子晶体,可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于该物质,下列说法正确的是()
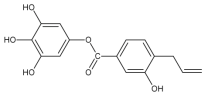
A.1mol该物质最多与8mol H2发生加成反应
B.1mol该物质最多与5mol Br2反应
C.1mol该物质最多与6mol NaOH发生反应
D.可以用酸性高锰酸钾溶液检验该物质中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.1.6g-NH2和1.5g-CH3含有的电子数均为NA
B.44 g CO2和N2O的混合物中含有的氧原子数为1. 5NA
C.精炼铜,若阳极失去2NA个电子,则阴极增重64 g
D.60 g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C—O键数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用石墨电极电解MgCl2溶液:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B.泡沫灭火器工作时化学反应:2Al3++3CO32-+6H2O=Al(OH)3↓+3CO2↑
C.向Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.硫化钠的水解反应;S2-+H3O+=HS-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图象的解释或结论正确的是![]()
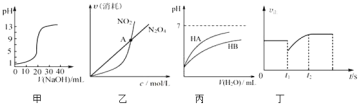
A.图甲表示用![]() 溶液滴定
溶液滴定![]()
![]()
![]() 醋酸溶液的滴定曲线
醋酸溶液的滴定曲线
B.由乙可知:对于恒温恒容条件下的反应![]() ,A点为平衡状态
,A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.图丁表示反应![]() ,
,![]() 时刻减小了压强
时刻减小了压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y在医药上具有广泛用途,可由X制得。下列有关化合物X、Y的说法正确的是( )

A.X分子中所有原子可能在同一平面上
B.1molY最多能与1molNaOH反应
C.X、Y均能与酸性KMnO4溶液反应
D.X、Y分别与足量H2加成的产物分子中手性碳原子数目不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两种硫酸盐按一定比例混合后共熔,可制得化合物M(化学式为xK2SO4·yCr2(SO4)3),若将2.83g化合物M中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr2O72-+3I2+7H2O,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀。
由此推断出化合物M中x:y为__。写出简要计算过程:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com