
| A. | Pb是正极 | B. | PbO2得电子,被氧化 | ||
| C. | 负极反应是:Pb-2e-+SO42-=PbSO4 | D. | 电池放电时,溶液酸性增强 |
分析 铅蓄电池放电时,负极是Pb、正极是PbO2,负极反应式为Pb+SO42--2e-═PbSO4,正极反应式为SO42-+PbO2+2e-+4H+═PbSO4+2H2O,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A.放电时,负极上Pb失电子发生氧化反应,故A错误;
B.根据电池反应式知,放电时,Pb为负极,PbO2得电子是正极,被还原,故B错误;
C、放电时Pb失电子发生氧化反应,则Pb为负极,电极反应式为Pb+SO42--2e-═PbSO4,故C正确;
D、电池放电时,根据电池反应为PbO2+Pb+H2SO4=2PbSO4+2H2O,硫酸钡消耗,所以溶液酸性减弱,故D错误.
故选C.
点评 本题考查原电池和电解池原理,为高频考点,明确得失电子与电极关系、电极反应式的书写是解本题关键,难点是电极反应式的书写,易错点是判断阴阳离子移动方向,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤代烃在生产生活中具有广泛的应用,回答下列问题:
卤代烃在生产生活中具有广泛的应用,回答下列问题:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度(g/cm3) | 0.79 | 1.44 | 3.1 |
| 沸点 | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
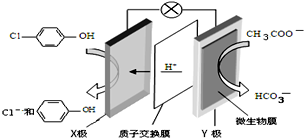 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示.下列有关说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示.下列有关说法错误的是( )| A. | Y极为该电池的负极 | |
| B. | X极的电极反应式为: +H++2e-═ +H++2e-═ +Cl- +Cl- | |
| C. | 可用硝酸酸化的硝酸银溶液验证正极产物 | |
| D. | 每处理1mol对氯酚,消耗8.2g乙酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HIO4>HBrO4>HClO4 | B. | 原子半径:Na>Cl>S | ||
| C. | 碱性:KOH>NaOH>LiOH | D. | 金属性:Na>Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
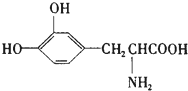 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )| A. | 只能与碱反应,不能与酸反应 | |
| B. | 1mol该物质最多与4molNaOH反应 | |
| C. | 该物质不能使酸性KMnO4褪色 | |
| D. | 1mol该物质最多可与1.5molHBr反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com