
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
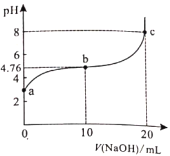
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)铝热反应在工业生产中的重要用途之一是_________________;用化学方程式表示出其中的原理________________________________________(举一例)。铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为____________________________________。
(2)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是____________(写化学式)。缺铁性贫血患者应补充Fe元素,通常以硫酸亚铁的形式给药,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_______________。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是_________。(用化学方程式表示)。
(4)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO。
①在化学方程式上标出该反应中电子转移的方向和数目。_________
②在该反应中,氧化剂是________________ ,氧化产物是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.( ![]() -
-![]() ) mol/LB.(2b-a) mol/L
) mol/LB.(2b-a) mol/L
C.(5b-![]() ) mol/LD.(10b-5a) mol/L
) mol/LD.(10b-5a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率________(填“增大”“减小”或“不变”)。
(2)已知几种化学键的键能数据如表(亚硝酰氯的结构式为Cl—N=O):
化学键 | NO | Cl—Cl | Cl—N | N=O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
(3)在1 L的恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图:
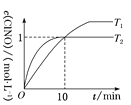
①从反应开始到10 min时NO的平均反应速率v(NO)=________mol·L-1·min-1。
②T2时该反应的平衡常数K=________。
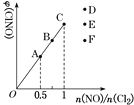
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数可能是D、E、F三点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
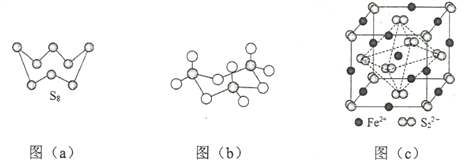
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
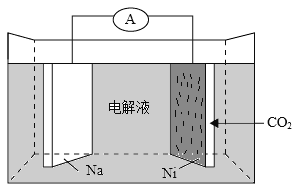
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是( )
A.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
B.硫酸铝溶液与过量的氨水反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.苯酚钠的水溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.醋酸钠的水解反应:CH3COO-+H3O+=CH3COOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子中有10个氢原子的烷烃的分子式是________________________________。
(2)已知下列三种有机物:
A.苯 B.乙醇 C.乙酸
回答下列问题
①写出苯的结构简式____________;
②能使紫色石蕊溶液变红的是____________(填字母代号);
③医疗上常用体积分数为75%的____________(填字母代号)作消毒剂;
④写出选取上述两种有机物在浓硫酸和加热条件下反应制备乙酸乙酯的化学方程式________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com