
【题目】化学与社会、生活密切相关。下列说法错误的是( )
A.蚕丝属于天然高分子材料
B.雾霾纪录片《穹顶之下》,提醒人们必须十分重视环境问题,提倡资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle)
C.化石燃料完全燃烧不会造成大气污染
D.中国古代用明矾溶液清洗铜镜表面的铜锈
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图:

(1)加快“浸取”速率除将辉铜矿粉碎外,还可采取的措施有_________ (任写一种);研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是________。
(2)滤渣I中的主要成分是MnO2、S、SiO2。请写出“浸取”反应中生成S的化学方程式:________。
(3)常温下“除铁”时加入的试剂A可用____________较为合适,若加A后溶液的pH调为5,则溶液中Fe3+ 的浓度为______mol/L。{Ksp[Fe(OH)3]=4.0×10- 38}
(4)写出“沉锰"(除Mn2+ )过程中反应的离子方程式:______。
(5)“赶氨”时,最适宜的操作方法是__________。
(6)滤液II经蒸发结晶得到的盐主要是________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)![]() H2(g)+I2(g),减小容器体积,气体颜色变深
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:

(1)铜为___极,导线中电子流向为___(用a、b表示)。
(2)若装置中铜电极的质量增加3.2g,则导线中转移的电子数目为___;(用若NA表示阿伏加德罗常数,“NA”表示)
(3)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是___。
A.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
B.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
C.盐桥中的K+、Cl-几乎都不移动
(4)若将反应2Fe3+ +Cu=2Fe2+ +Cu2+设计成原电池,其正极反应是___。
(5)设计一个电化学装置,实现这个反应:Cu+H2SO4=CuSO4+H2↑,请在下面方框内画出这个电化学装置图。___

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_____△H2(填“>”“<”或“=”,下同)。
(2)相同条件下,1 mol P4所具有的能量_______4 mol P原子所具有的能量。
(3)己知P4(白磷,s)![]() 4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
①P4(白磷,s)+5O2(g)=P4O10(s) △H1,
②4P(红磷,s)+5O2(g)=P4O10(s) △H2。
(4)己知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ· mol-1,则浓硫酸与稀氢氧化钠溶液反应生成2 mol水,放出的热量______114.6kJ。
(5)己知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了a kJ热量,该反应的热化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B. 已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2
C. 已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
D. 已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___,基态D原子价电子的轨道表达式为___,DA2分子的VSEPR模型是___。
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
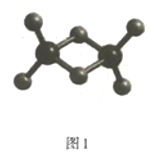
①C2Cl6属于___晶体(填晶体类型),其中C原子的杂化轨道类型为___杂化。
②[C(OH)4]-中存在的化学键有___。
③C2Cl6与过量的NaOH溶液反应的化学方程式为___。
(3)B、C的氟化物晶格能分别是2957kJmol-1、5492kJmol-1,二者相差很大的原因是___。
(4)D与E所形成化合物晶体的晶胞如图2所示。
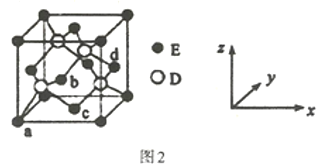
①在该晶胞中,E的配位数为___。
②已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为___pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d四种短周期元素在周期表中的位置如图所示,a和b分别位于周期表的第2列和第13列,下列叙述正确的( )

A.离子半径b>d
B.b可以和强碱溶液发生反应
C.c的最简单氢化物的空间结构为三角锥形
D.a的最高价氧化物对应水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2具有独有的脱色能力,适用于印染、造纸行业的污水处理。FeCl3在加热条件下遇水剧烈水解。FeCl3和FeCl2均不溶于C6H5Cl、C6H4Cl2、苯。回答下列问题:
(1)由FeCl36H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl36H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后加热,生成FeCl2。
①FeCl36H2O中加入SOCl2获得无水FeCl3的化学方程式为________。(已知该反应为非氧化还原反应)
② ii中通入一段时间的氢气后再加热的目的是__________。
(2)利用反应2FeCl3 + C6H5Cl![]() 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)

①仪器B的名称是 _____。反应前需向A中通入N2的目的是________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经____、____、干燥后,得到FeCl2粗产品。
③该装置存在的不足之处是__________。
(3)FeCl2的纯度测定。
①取a g样品配制成100 mL溶液;③用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水200mL;③往上述锥形瓶中加入硫酸锰溶液20.00 mL,用0.1 molL-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。滴定至终点的判断依据是______________。若所配溶液中ω(FeCl2)=kV(V为消耗的酸性高锰酸钾标准溶液的毫升数)g·L-1,k=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com