
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
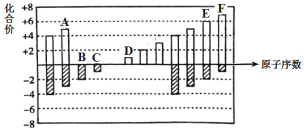
(1)元素F在周期表中的位置是 ______。
(2)元素C、D、E原子半径由大到小的顺序是 ______(填元素符号)。
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序_____(用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______、__(写2种)。
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 _____(填“能”或“不能”), 若能则写出反应的化学方程式 ______。
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ![]() 2AB2(g)。可以作为达到平衡状态的标志是 ______。
2AB2(g)。可以作为达到平衡状态的标志是 ______。
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变
【答案】第3周期ⅦA族 Na>S>F F2>O2>N2 Na2S Na2S2 能 Cl2+H2S=S+2HCl BC
【解析】
有六种元素的原子序数与主要化合价的关系图可知:A,B,C,D,E,F的元素符号分别为:N,O,F,Na,S,Cl。
(1)元素F是Cl,在周期表中的位置是第3周期ⅦA族;
(2)同周期原子半径逐渐增大,同主族原子半径从上到下逐渐增大,故元素C、D、E原子半径由大到小的顺序是Na>S>F ; (3)同周期随原子序数的增加非金属性逐渐增强,非金属性越强与氢气反应的剧烈程度越强,故顺序为F2>O2>N2;
(4)钠的化合价是+1价,硫在化合物中的价态有-2,-1价,故形成的化合物为Na2S,Na2S2
(5)氯的非金属性比硫强,所以能反应,反应的化学方程式Cl2+H2S=S+2HCl;
(6)A. 单位时间内生成nmolB2的同时生成2nmolAB,是同一个方向,故错误;
B. 2 ν正(B2)=ν逆(AB2),可以得出ν正(B2)=ν逆(B2),故正确;
C. 混合气体的颜色不再改变,说明NO2的浓度不变,处于平衡状态;
D. 混合气体的密度不变不能作为平衡状态的依据,因为反应物生成物都是气体,气体质量不变,体积不变,故密度不变,故错误。


科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
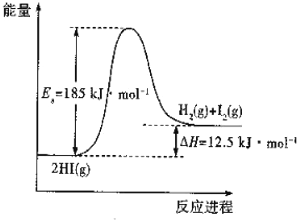
A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由10%的金和90%的铂制成的合金材料耐磨性比高强度钢高100倍,是迄今最强的合金,可用于制造新型发电系统和发电机。关于该合金材料说法正确的是
A.属于金属材料B.属于无机非金属材料
C.属于硅酸盐材料D.属于合成高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃A中碳、氢元素质量比为24:5,D与含NaOH的Cu(OH)2悬浊液在加热条件下反应并得到砖红色沉淀,F为具有浓郁香味、不易溶于水的油状液体,且RCl+NaOH![]() ROH+NaCl,其转化关系如图所示:
ROH+NaCl,其转化关系如图所示:

请回答:
(1)E中官能团的名称______。
(2)C→B的反应类型_______。
(3)D→E的化学方程式是______。
(4)H与NaOH溶液反应的方程式_______。
(5)下列说法不正确的是_______。
A.工业上通过石油裂解可实现A→B+C
B.利用植物秸秆在一定条件下通过水解反应可以直接得到有机物G
C.可用Na2CO3溶液鉴别D、G
D.完全燃烧等物质的量的C、D、E消耗O2的量依次减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的根本区别是
A. 是否能透过滤纸 B. 分散质粒子直径的大小
C. 是否是大量分子或离子的集合体 D. 是否为均一、稳定、透明的外观
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯水能导电,所以氯气是电解质
B.碳酸钙难溶于水,所以它是非电解质
C.固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电
D.胆矾虽不能导电,但它属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性如图甲可通过观察________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________________________,H2O2在二氧化锰催化作用下发生反应的化学方程式为____________________________________。
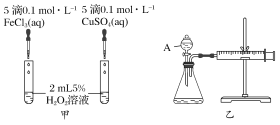
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com