
盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步完成,整个过程的热效应是相同的。已知:
①H2O(g)====H2O(l) ΔH1=-Q1kJ·mol-1
②C2H5OH(g)====C2H5OH(l) ΔH2=-Q2kJ·mol-1
③C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH3=- Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)( )
A.Q1+ Q2+ Q3 B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3 D.0.5(Q1+Q2+Q3)
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.化学变化过程是原子的重新组合过程
B.根据化学反应中的能量变化情况,化学反应可分为吸热反应和放热反应
C.化学反应中的能量变化多少与其反应物用量有关
D.化学反应中的能量变化都是以热能形式表现出来的
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中以下物质的贮存方法不正确的是( )
A.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质加入足量水,形成悬浊液,一段时间后,加入过量盐酸,浑浊部分消失且有无色无味气体生成的是( )
A.Ba(NO3)2和Na2SO3 B.BaCO3和Na2SO4
C.BaCl2和Na2SO4 D.Ca(HCO3)2和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
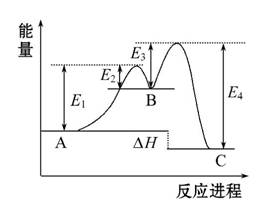 某反应由两步反应A
某反应由两步反应A B
B C构成,它的反应能量曲线如右图(E1、E2、E3、E4表示活化能)。
C构成,它的反应能量曲线如右图(E1、E2、E3、E4表示活化能)。
下列有关叙述正确的是( )
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知:
A(s)+B(g)====C(g)+D(g) ΔH=+131.4 kJ·mol-1,
某同 学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
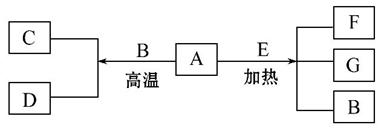
(1) 写出A元素的名称________。
写出A元素的名称________。
(2)另外知:A(s)+O2(g)====G(g) ΔH=-393.6 kJ·mol-1
C(g)+ O2(g)====G(g) ΔH=-283 kJ·mol-1
O2(g)====G(g) ΔH=-283 kJ·mol-1
D(g)+ O2(g)====B(g) ΔH=-242 kJ·mol-1
O2(g)====B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?___________,理由是___[.Com ]
]
____________________________________________________。
(3)写出A+O2→C的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、 S2-、Ca2+、K+半径逐渐减小
S2-、Ca2+、K+半径逐渐减小
D. 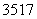 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: 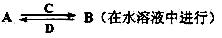
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B 为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为
为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为  。
。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则H CN在水溶液中电离的ΔH等于 ( )。
CN在水溶液中电离的ΔH等于 ( )。
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com