
| 2.24L |
| 22.4L/mol |
| 2.24L |
| 22.4L/mol |
| 0.1mol |
| 0.1L |


科目:高中化学 来源:2011年高考化学总复习30分钟限时训练:专题3 金属及其化合物 题型:022
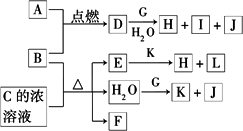
下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.
回答下列问题:
(1)K名称为________,所含的化学键有________.
(2)①D的水溶液呈棕黄色,则D的水溶液与G反应的离子方程式为________.
②少量B与C的浓溶液加热时反应的化学方程式为________.
(3)①若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的下列关系式为________(填代号).
A.c(Na+)+c(H+)=c(OH-)+c(HSO![]() )+2c(SO
)+2c(SO![]() )
)
B.2c(Na+)=3c(H2SO3)+3c(HSO![]() )+3c(SO
)+3c(SO![]() )
)
C.c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H2SO3)
)>c(H2SO3)
D.c(OH-)>c(H+)
②若将标准状况下2.24 L的F通入150 mL 1 mol·L-1的K溶液中.则所得溶液中各粒子浓度关系满足的上述关系式为________(填代号).
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出典例3中有关反应的离子方程式。
(2)将典例3中反应后所得溶液加热煮沸,有何现象?写出反应的离子方程式。
(3)若将标准状况下2.24 L二氧化碳通入400 mL 0.3 mol·L-1的氢氧化钾溶液中,生成何种物质?其物质的量分别是多少??
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
I、把氯气通入含淀粉碘化钾的溶液中,可观察到的现象是: ,
说明氯单质的氧化性 碘单质的氧化性。(填﹤,﹥,=)
Ⅱ、某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用离子方程式表示) 。
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液需要 L才能与标准状况下2.24 L氯气恰好完全反应。
(3)配制250 mL 4.0mol·L-1NaOH溶液的实验步骤:
a、计算需要氢氧化钠固体的质量。
b、称量氢氧化钠固体。
c、将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入250 mL容量瓶。
d、用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e、盖好瓶塞,反复上下颠倒,摇匀。
f、继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管加蒸馏水至凹液面最低液而与刻度线相切。
①所需称量的氢氧化钠固体的质量是 。
②上述步骤的正确操作顺序是 。
③上述实验需要的仪器有:天平、药匙、烧杯、玻璃棒、 、 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省龙岩一中高一第二学段(模块)考试化学试卷 题型:实验题
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
I、把氯气通入含淀粉碘化钾的溶液中,可观察到的现象是: ,
说明氯单质的氧化性 碘单质的氧化性。(填﹤,﹥,=)
Ⅱ、某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用离子方程式表示) 。
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液需要 L才能与标准状况下2.24 L氯气恰好完全反应。
(3)配制250 mL 4.0mol·L-1NaOH溶液的实验步骤:
a、计算需要氢氧化钠固体的质量。
b、称量氢氧化钠固体。
c、将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入250 mL容量瓶。
d、用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e、盖好瓶塞,反复上下颠倒,摇匀。
f、继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管加蒸馏水至凹液面最低液而与刻度线相切。
①所需称量的氢氧化钠固体的质量是 。
②上述步骤的正确操作顺序是 。
③上述实验需要的仪器有:天平、药匙、烧杯、玻璃棒、 、 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期化学一轮复习《从海水中获得化学物质》专题综合测试(苏教版) 题型:填空题
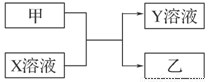
(9分)甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y是化合物。X溶液呈淡绿色。它们之间有如下图所示转化关系。
请回答:
(1)实验室制取甲的化学方程式为___________________________________________。
若制得标准状况下2.24 L甲,则被氧化的物质的质量为________。
(2)将甲通入石蕊溶液中发生的颜色变化为
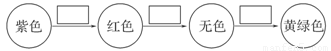
请在方框内填写出导致该阶段颜色变化的粒子符号。
(3)将Y溶液滴入沸水可得红褐色液体,反应的离子方程式是___________________。
(4)取100 mL 0.1 mol/L的X溶液,通入一定量的甲时,共转移1.204×1022个电子,该反应的离子方程式是________________________________________________________
________________________________________________________________________。
(5)在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入乙,乙被还原,由此可推断溶液中一定含有________离子;一定不含有________离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com