
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
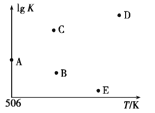
(3)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:
CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。

①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)
②506 K时,反应平衡时H2的转化率为___;压强:p1_____(填“>”“<”或“=”) p2。
③反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。
④若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图所示。则温度为506 K时,平衡常数K=____(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____。
(4)在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________。
【答案】-90.1 A 低温 25% > < 0.148 BE 0<a<10
【解析】
(1)根据盖斯定律③/2-①/2得反应②的△H2=(△H3-△H1)/2=-90.1kJ·mol-1。
(2)A.当改变某一条件时,正反应速率先增大后减小,说明开始时平衡逆向移动,后来平衡正向移动,反应物浓度降低导致正反应速率减小,故A项正确;B.化学平衡常数K减少,反应程度减小,所以平衡逆向移动,故B项错误;C .再加入一定量碳,因为C是固体,改变用量,不影响化学平衡移动,故C错误;D.反应物气体体积分数增大,说明平衡逆向移动,故D项错误。综上所述,符合题意的选项为A
(2)①由图分析CO(g)+2H2(g)![]() CH3OH(g)为放热反应,所以自发进行的条件是低温;
CH3OH(g)为放热反应,所以自发进行的条件是低温;
②506 K M点生成0.25mol CH3OH消耗0.5mol H2,H2的转化率为0.5/2=;加压平衡右移,CH3OH的物质的量增大,p1时CH3OH的物质的量较大,所以压强:p1>p2。答案:25%、p1>p2。
③M、N点温度相同,M点压强较大,所以反应速率:N点v正(CO) <M点v逆(CO)。答案:<
④506 K时, CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol·L-1) 1 2 0
转化(mol·L-1) 0.25 0.50 0.25
平衡(mol·L-1) 0.75 1.50 0.25
K=![]() =
=![]() L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意。答案:0.148 BE。
L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意。答案:0.148 BE。
(4)温度不变,平衡常数不变,K=0.148 L2·mol-2。为了使反应逆向进行,必须使Qc>K,即![]() >0.148,解得:a<10,又因为H2的物质的量必须大于0,所以,a的范围为0<a<10。
>0.148,解得:a<10,又因为H2的物质的量必须大于0,所以,a的范围为0<a<10。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在下列各组物质中:
A O2和O3 B 氘和氚 C CH4和CH3(CH2)2CH3
D ![]() 和
和![]() E CH3(CH2)2CH3和
E CH3(CH2)2CH3和![]()
①互为同位素的是__________
②互为同素异形体的是______
③互为同系物的是__________
④互为同分异构的是_____.(均填选项号)
(2)下列各种物质:①H2O ②NH3 ③KOH ④Na2O2 ⑤MgCl2 ⑥He,,不存在化学键的是____;只存在离子键的是_____;属于共价化合物的是_____;含非极性键的离子化合物是 ____。
(3)CO2的电子式为___________________;NH3的结构式为___________________;
(4)Na2O2熔化时被破坏的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]() NH4++OH
NH4++OH
B. 由Na和C1形成离子键的过程:![]()
C. 电解精炼铜的阴极反应:Cu2+ +2e=Cu
D. 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是
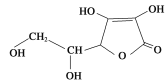
A. 维生素C中含有3种官能团
B. 维生素C分子式为C6H8O6
C. 维生素C能使酸性高锰酸钾溶液褪色
D. 维生素C在碱性溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A-E能发生下图所示一系列变化,则下列说法错误的是( )
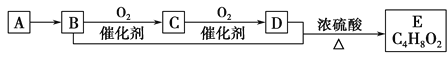
A. A分子中所有原子均在同一平面内
B. C4H8O2含酯基的同分异构体有6种
C. D可与Na2CO3溶液反应
D. 等物质的量的B、D与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
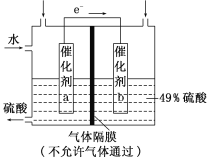
A. 该装置将化学能转化为电能
B. 催化剂b表面O2发生还原反应,其附近酸性增强
C. 催化剂a表面的反应是:SO2+2H2O-2e-===SO42-+4H+
D. 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:
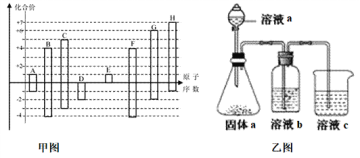
请回答下列问题:
(1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________(写化学式),A和E形成的化合物的电子式为_____________。
(2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示)
(3)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式_________________。
(4)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为________,________(填化学式)。
②溶液c中的离子方程式为__________________________________________。
③请从原子结构的角度解释非金属性C>B的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“电化学”与人类生产和生活密不可分。
(1)如图为相互串联的甲、乙两个电解池,试回答下列问题。
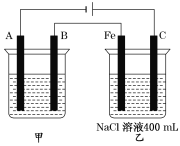
①甲池若为用电解原理精炼铜的装置,A极电极反应式为___________。
②乙池中若滴入少量酚酞溶液,开始一段时间后,____电极附近呈红色(填“铁”或“碳”)。
③甲池若为用电解原理精炼铜的装置,阴极增重12.8 g时,则乙池阳极放出气体在标准状况下的体积为________(不考虑气体溶解情况)。
(2)肼(N2H4)—空气燃料电池是一种环境友好型碱性电池,该电池放电时,负极的反应式为_______。
(3)人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
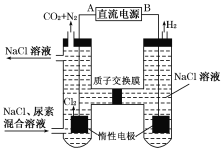
①阳极反应生成的氯气将尿素氧化而得以除去,试写出该反应的化学方程式________________。
②电解结束后,阴极室溶液的pH与电解前相比将________(填增大、减小或不变);若两极共收集到气体13.44 L(标况),则除去的尿素为________ g(忽略气体的溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com