
分析 (1)2Na2O2+2H2O═4NaOH+O2↑中只有O元素的化合价变化,过氧化钠为氧化剂也为还原剂;
(2)二氧化硅与碱反应生成具有粘合性的硅酸钠,则不能使用玻璃塞.
解答 解:(1)2Na2O2+2H2O═4NaOH+O2↑中只有O元素的化合价变化,过氧化钠为氧化剂也为还原剂,该反应转移2e-,“双线桥”表示电子转移的方向和数目为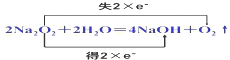 ,每消耗3molNa2O2转移电子为3mol,失去电子被氧化,则O2是氧化产物,Na2O2的一个常见用途为作供氧剂,
,每消耗3molNa2O2转移电子为3mol,失去电子被氧化,则O2是氧化产物,Na2O2的一个常见用途为作供氧剂,
故答案为: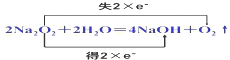 ;3;O2;供氧剂;
;3;O2;供氧剂;
(2)二氧化硅与碱反应生成具有粘合性的硅酸钠,则不能使用玻璃塞,发生的反应为SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4和NaHSO4都属于酸 | B. | 火碱和纯碱都属于碱 | ||
| C. | KOH和NH3•H2O都属于电解质 | D. | Na2O和Na2O2都属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
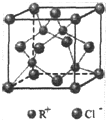 RCl常用作有机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M三个电子层,它与Cl-形成的晶体结构如图所示.R的元素符号是Cu,每个Cl-周围最近的Cl-有12个.
RCl常用作有机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M三个电子层,它与Cl-形成的晶体结构如图所示.R的元素符号是Cu,每个Cl-周围最近的Cl-有12个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:4 | B. | 6:1 | C. | 7:6 | D. | 11:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3- | |
| B. | 0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42- | |
| C. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com