
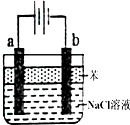
 (1)用惰性电极电解饱和食盐水的反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(1)用惰性电极电解饱和食盐水的反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.分析 (1)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气;
与电源负极相连的电极是阴极,阴极上氢离子放电同时电极附近生成NaOH,溶液呈碱性;
(2)两个电极材料分别是Fe和石墨,用该装置可制得Fe(OH)2沉淀,说明Fe作阳极,石墨作阴极,阳极上铁失电子生成亚铁离子.
解答 解:(1)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
与电源负极相连的电极是阴极,阴极上氢离子放电同时电极附近生成NaOH,溶液呈碱性,则溶液的pH制得,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;增大;
(2)两个电极材料分别是Fe和石墨,用该装置可制得Fe(OH)2沉淀,说明Fe作阳极,石墨作阴极,阳极上铁失电子生成亚铁离子,则a极材料是Fe,电极反应式为Fe-2e-=Fe2+,故答案为:Fe;Fe-2e-=Fe2+.
点评 本题考查电解原理,明确各个电极上发生的反应是解本题关键,难点是(2)题中正负极判断,根据实验目的判断,注意电解池中,如果阳极材料是较活泼金属,阳极上金属失电子而不是电解质溶液中阴离子失电子.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:解答题
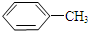 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$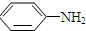

 ,G
,G .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. 与碳酸氢钠溶液反应:
与碳酸氢钠溶液反应: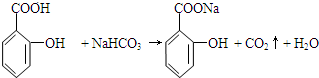 .
.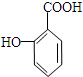 有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.
有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be2+中的质子和电子 | |
| B. | NaHCO3晶体中的阳离子和阴离子 | |
| C. | ${\;}_{1}^{2}$H原子中的中子和质子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾能净水:Al3++3H2O?Al(OH)3+3H+ | |
| B. | 醋酸溶液显酸性:CH3COOH=CH3COO-+H+ | |
| C. | NaHCO3溶液显碱性:HCO3-+H2O?CO32-+OH- | |
| D. | Fe(OH)3胶体的制备:Fe3++3H2O=Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| W | M | Q |
| A. | W的最高价氧化物可以和Z的氢化物反应 | |
| B. | X、Y、Z三种元素的原子半径由大到小的顺序为Z>Y>X | |
| C. | X的含10个电子的气态氢化物可以与X的最高价氧化物对应的水化物溶液反应生成盐 | |
| D. | 工业上电解Q元素的钠盐溶液可获得一种含Q元素的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 乙醇、乙酸均能与钠反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:O<S<Na | |
| B. | 碱性强弱:LiOH>KOH>CsOH | |
| C. | 还原性:HCl>HBr>HI | |
| D. | 热稳定性:H2O<NH3<SiH4的依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com