
”¾ĢāÄæ”æNa2O2ŹĒ֊ѧ»Æѧ³£ÓƵÄĒæŃõ»Æ¼Į£¬³żĮĖÄÜÓėCO2”¢H2O·“Ó¦Ķā£¬»¹æÉÓėĘäĖū»¹Ō¼ĮČēH2”¢C·¢Éś·“Ó¦£¬Ä³»ÆѧæĪĶāŠĖȤŠ”×éĪŖĢ½¾æNa2O2ÓėH2µÄ·“Ó¦Ēéæö£¬Éč¼ĘĮĖČēĻĀĶ¼ĖłŹ¾×°ÖĆ½ųŠŠÓŠ¹ŲŹµŃ锣

£Ø1£©“Ė×°ÖĆÖŠ£¬ŌõŃł¼ģ²é³żĘōĘÕ·¢ÉśĘ÷Ö®ĶāµÄ×°ÖƵÄĘųĆÜŠŌ£æ_________________________________”£
£Ø2£©ĒėĶź³ÉøĆŹµŃéµÄÓŠ¹Ų²Ł×÷²½Öč”£
¢Ł¼ģ²é×°ÖĆĘųĆÜŠŌ£»
¢Ś“ņæŖa”¢b²śÉśĒāĘų£¬¹Ū²ģŹŌ¹ÜÄŚĪļÖŹµÄŃÕÉ«±ä»Æ£»
¢Ū____________________________________________________£»
¢Ü¼ÓČČ¹żŃõ»ÆÄĘ£¬¹Ū²ģŹŌ¹ÜÄŚĪļÖŹµÄŃÕÉ«±ä»Æ£»
¢Ż·“Ó¦ĶźČ«ŗó£¬__________________________________________£»
¢Ž²šŠ¶×°ÖĆ”£
£Ø3£©øĆ×°ÖĆÖŠ£¬¼īŹÆ»ŅµÄ×÷ÓĆŹĒ_________________________ ”£
£Ø4£©ŹµŃé¹ż³ĢÖŠ¹Ū²ģµ½(2)ÖŠ²½Öč¢ŚĪŽĆ÷ĻŌ±ä»Æ£¬²½Öč¢ÜNa2O2ČŪ»Æŗ󣬻ĘÉ«·ŪÄ©Į¢¼“±ä³É°×É«£¬øÉŌļ¹ÜÄŚĮņĖįĶĪ“±ä³ÉĄ¶É«”£ŌņNa2O2ÓėH2·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________”£
”¾“š°ø”æ ¹Ų±Õa£¬ŌŚb“¦Į¬½ÓŅ»µ¼¹Ü²¢ÉģČėĖ®²ŪÖŠ£¬ÓĆŹÖĪęČČŹŌ¹Ü(»ņÉŌÉŌ¼ÓČČŹŌ¹Ü)£¬Čō¹Ū²ģµ½µ¼¹ÜæŚÓŠĘųÅŻĆ°³ö£¬ĄäČ“ŹŌ¹Üŗóµ¼¹ÜÖŠÄÜŠĪ³ÉŅ»¶ĪĪČ¶ØµÄĖ®Öł£¬ŌņĖµĆ÷×°ÖĆĘųĆÜŠŌĮ¼ŗĆ ŌŚøÉŌļ¹ÜÉĻµ¹²åŅ»Ö§Š”ŹŌ¹ÜŹÕ¼ÆH2£¬¼ģŃéH2µÄ“æ¶Č ĻČ³·Ąė¾Ę¾«µĘ£¬“żŹŌ¹ÜĄäČ“ŗó¹Ų±Õb ³żČ„H2ÖŠµÄHClŗĶĖ®ÕōĘų Na2O2£«H2![]() 2NaOH
2NaOH
”¾½āĪö”æŹŌĢā·ÖĪö£ŗ±¾ĢāĶعżĢ½¾æNa2O2ÓėH2µÄ·“Ó¦£¬æ¼²é×°ÖĆĘųĆÜŠŌµÄ¼ģ²é£¬²¹³äŹµŃé²½Öč£¬ŹµŃéĻÖĻóµÄ·ÖĪö£¬»Æѧ·½³ĢŹ½µÄŹéŠ“”£
£Ø1£©¼ģ²é³żĘōĘÕ·¢ÉśĘ÷Ö®ĶāµÄ×°ÖƵÄĘųĆÜŠŌæÉÓĆĪ¢ČČ·Ø£¬¾ßĢå²Ł×÷ĪŖ£ŗ¹Ų±Õa£¬ŌŚb“¦Į¬½ÓŅ»µ¼¹Ü²¢ÉģČėĖ®²ŪÖŠ£¬ÓĆŹÖĪęČČŹŌ¹Ü£Ø»ņÉŌÉŌ¼ÓČČŹŌ¹Ü£©£¬Čō¹Ū²ģµ½µ¼¹ÜæŚÓŠĘųÅŻĆ°³ö£¬ĄäČ“ŹŌ¹Üŗóµ¼¹ÜÖŠÄÜŠĪ³ÉŅ»¶ĪĪČ¶ØµÄĖ®Öł£¬ŌņĖµĆ÷×°ÖĆĘųĆÜŠŌĮ¼ŗĆ”£
£Ø2£©²½Öč¢ŚÓĆĄ“Ģ½¾æH2ÓėNa2O2³£ĪĀĻĀÄÜ·ń·“Ó¦£¬Ķ¬Ź±æɽ«×°ÖĆÖŠæÕĘųÅųö£»²½Öč¢Ü¼ÓČČ¹żŃõ»ÆÄĘ£¬ÓĆĄ“Ģ½¾æH2ÓėNa2O2¼ÓČČŹ±µÄ·“Ó¦£»ÓÉÓŚŅŖ¼ÓČČ£¬¶ųH2²»“æŹ±»į·¢Éś±¬ÕØ£¬ĖłŅŌ¼ÓČČ¹żŃõ»ÆÄĘÖ®Ē°ŅŖ¼ģŃéH2µÄ“æ¶Č£¬Ōņ²½Öč¢ŪĪŖŌŚøÉŌļ¹ÜÉĻµ¹²åŅ»Ö§Š”ŹŌ¹ÜŹÕ¼ÆH2£¬¼ģŃéH2µÄ“æ¶Č”£ŹµŃé½įŹųŹ±£¬ĪŖĮĖ·ĄÖ¹Ķā½ēæÕĘų“ÓøÉŌļ¹Ü½ųČėŹŌ¹ÜÖŠŹ¹H2²»“æ·¢Éś±¬ÕØ£¬²½Öč¢ŻÓ¦ĻČ³·Ąė¾Ę¾«µĘ£¬“żŹŌ¹ÜĄäČ“ŗó¹Ų±Õb£Ø¼““żŹŌ¹ÜĄäČ“ŗóĶ£Ö¹ĶØČėH2£©”£
£Ø3£©ÓĆĢśĮ£ŗĶĻ”ŃĪĖį·“Ó¦ÖʵƵÄH2ÖŠ»ģÓŠHClŗĶH2O£Øg£©£¬HClŗĶH2O£Øg£©¶¼ÄÜÓėNa2O2·“Ó¦£¬øÉČÅĢ½¾æNa2O2ÓėH2µÄ·“Ó¦£¬¼īŹÆ»ŅµÄ×÷ÓĆŹĒ³żČ„H2ÖŠµÄHClŗĶH2O£Øg£©”£
£Ø4£©²½Öč¢ŚÖŠĪŽĆ÷ĻŌ±ä»Æ£¬Na2O2ÓėH2³£ĪĀĻĀ²»·“Ó¦£»²½Öč¢ÜNa2O2ČŪ»Æ£¬»ĘÉ«·ŪÄ©±ä³É°×É«£¬øÉŌļ¹ÜÄŚĮņĖįĶĪ“±ä³ÉĄ¶É«£¬ĖµĆ÷·“Ӧƻӊɜ³ÉH2O£¬ĖµĆ÷Na2O2ÓėH2¼ÓČČŹ±·“Ӧɜ³ÉNaOH£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖNa2O2+H2![]() 2NaOH”£
2NaOHӣ


 ĆūĢāѵĮ·ĻµĮŠ“š°ø
ĆūĢāѵĮ·ĻµĮŠ“š°ø ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCO2ÓėH2µÄ»ģŗĻĘųĢå5g£¬ŌŚ150”ꏱŗĶ×ćĮæµÄŃõĘų»ģŗĻ£¬ÓƵē»š»Ø³ä·ÖŅżČ¼£¬ŌŚĻąĶ¬×“æöĻĀŌŁ½«·“Ó¦ŗóĖłµĆ»ģŗĻĘųĢåĶØČėµ½×ćĮæµÄNa2O2ÖŠ£¬²āµĆNa2O2¹ĢĢåŌöÖŲµÄÖŹĮæĪŖ3.4g£¬ŌņŌ»ģŗĻĘųĢåÖŠCO2µÄĪļÖŹµÄĮæ·ÖŹżĪŖ£Ø £©
A. 25% B. 75% C. 88% D. 32%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCO2µÄ»ŲŹÕĄūÓƶŌ¼õÉŁĪĀŹŅĘųĢåÅÅ·Å”¢øÄÉĘČĖĄąÉś“ę»·¾³¾ßÓŠÖŲŅŖŅāŅ壮ĄūÓĆCO2ŗĶCH4ÖŲÕūæÉÖĘŗĻ³ÉĘų£ØÖ÷ŅŖ³É·ÖCO”¢H2£©£¬ÖŲÕū¹ż³ĢÖŠ²æ·Ö·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ ¢ŁCH4£Øg£©ØTC£Øs£©+2H2£Øg£©”÷H=75.0kJmol©1
¢ŚCO2£Øg£©+H2£Øg£©ØTCO£Øg£©+H2O£Øg£©”÷H=41.0kJmol©1
¢ŪCO£Øg£©+H2£Øg£©ØTC£Øs£©+H2O£Øg£©”÷H=©131.0kJmol©1
£Ø1£©·“Ó¦CO2£Øg£©+CH4£Øg£©ØT2CO£Øg£©+2H2£Øg£©µÄ”÷H= £®
£Ø2£©¹Ģ¶Øn£ØCO2£©=n£ØCH4£©£¬øı䷓ӦĪĀ¶Č£¬CO2ŗĶCH4µÄĘ½ŗā×Ŗ»ÆĀŹ¼ūĶ¼1£® 
¢ŁĶ¬ĪĀ¶ČĻĀCO2µÄĘ½ŗā×Ŗ»ÆĀŹ£ØĢī”°“óÓŚ”±»ņ”°Š”ÓŚ”±£©ÓŚCH4µÄĘ½ŗā×Ŗ»ÆĀŹ£¬ĘäŌŅņŹĒ £®
¢ŚøßĪĀĻĀ½ųŠŠøĆ·“Ó¦Ź±³£»įŅņ·“Ó¦¢ŁÉś³É”°»żĢ¼”±£ØĢ¼µ„ÖŹ£©£¬Ōģ³É“߻ƼĮÖŠ¶¾£¬øßĪĀĻĀ·“Ó¦¢ŁÄÜ×Ō·¢½ųŠŠµÄŌŅņŹĒ £®
£Ø3£©Ņ»¶ØĢõ¼žĻĀPd©Mg/SiO2“߻ƼĮæÉŹ¹CO2”°¼×Ķé»Æ”±“Ó¶ų±ä·ĻĪŖ±¦£¬Ęä·“Ó¦»śĄķČēĶ¼2ĖłŹ¾£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £¬ ·“Ó¦¹ż³ĢÖŠĢ¼ŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ©2¼ŪµÄÖŠ¼äĢåŹĒ £® 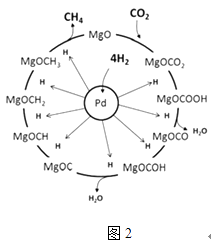
£Ø4£©Ā±Ė®æÉŌŚĪüŹÕŃĢµĄĘųÖŠCO2µÄĶ¬Ź±±»¾»»Æ£¬ŹµĻÖŅŌ·ĻÖĪ·Ļ£¬ĘäÖŠÉę¼°µÄŅ»øö·“Ó¦ŹĒCaSO4+Na2CO3ØTCaCO3+Na2SO4 £¬ Ōņ“ļµ½Ę½ŗāŗó£¬ČÜŅŗÖŠ ![]() = £® [ÓĆKsp£ØCaSO4£©ŗĶKsp£ØCaCO3£©±ķŹ¾]£®
= £® [ÓĆKsp£ØCaSO4£©ŗĶKsp£ØCaCO3£©±ķŹ¾]£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧ·“Ó¦ŹĒ¾É¼ü¶ĻĮŃŗĶŠĀ¼üŠĪ³ÉµÄ¹ż³Ģ”£¹²¼Ū¼üµÄ¼üÄÜŹĒĮ½ÖÖŌ×Ó¼äŠĪ³É1 mol¹²¼Ū¼ü(»ņĘäÄę¹ż³Ģ)Ź±ŹĶ·Å(»ņĪüŹÕ)µÄÄÜĮ攣ŅŃÖŖĻĀĆę»Æѧ¼üµÄ¼üÄÜ£ŗ H”ŖH Br”ŖBr H”ŖBr ¼üÄÜ(kJ”¤mol£1) 436 193 366£¬ŌņBr2(g)£«H2(g)£½2HBr(g)µÄ·“Ó¦ČȦ¤HµČÓŚ( )
A. -183 kJ”¤mol£1B. 183 kJ”¤mol£1C. -103 kJ”¤mol£1D. 103 kJ”¤mol£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠpH=5µÄCH3COOHČÜŅŗ¼ÓĖ®Ļ”ŹĶ1000±¶£¬Ļ”ŹĶŗóČÜŅŗÖŠµÄ£Ø £©
A.pH=8
B.pH=7
C.pH=6
D.pHĪŽĻŽ½Ó½ü7
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪŽÉ«ČÜŅŗ¼ÓČėĀĮæÉŅŌÉś³ÉH2£¬ŌņŌŚøĆČÜŅŗÖŠŅ»¶ØÄÜ“óĮæ“ęŌŚµÄĄė×Ó×éŹĒ(””””)
A. K£«”¢Cu2£«”¢NO![]() ”¢Cl£ B. K£«”¢Na£«”¢Br£”¢Cl£
”¢Cl£ B. K£«”¢Na£«”¢Br£”¢Cl£
C. K£«”¢Ca2£«”¢HCO![]() ”¢Cl£ D. Na£«”¢Mg2£«”¢Br£”¢SO
”¢Cl£ D. Na£«”¢Mg2£«”¢Br£”¢SO![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠSO2µÄ“ß»ÆŃõ»Æ·“Ó¦£®ČōĘšŹ¼Ź±c£ØSO2£©=c£ØO2£©=6mol/L£¬Ę½ŗāŹ±²āµĆc£ØO2£©=4.5mol/L£¬ŌņĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ£Ø £©
A.SO2µÄ×Ŗ»ÆĀŹĪŖ60%
B.SO3µÄ²śĀŹĪŖ60%
C.Ę½ŗāŹ±×ÜŃ¹ĒæÓėĘšŹ¼Ń¹ĒæÖ®±ČĪŖ7£ŗ8
D.Ę½ŗāŹ±V£ØSO2£©£ŗV£ØO2£©£ŗV£ØSO3£©=3£ŗ3£ŗ1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄųŹĒÖŲŅŖµÄÓŠÉ«½šŹōÖ®Ņ»£¬µ«“ÖÄųÖŠŅ»°ćŗ¬ÓŠFe”¢Cu¼°ÄŃÓėĖį”¢¼īČÜŅŗ·“Ó¦µÄ²»ČÜŠŌŌÓÖŹ¶ųÓ°ĻģŹ¹ÓĆ£®ĻÖ¶Ō“ÖÄų½ųŠŠĢį“棬¾ßĢåµÄ·“Ó¦Į÷³ĢČēĻĀ£ŗ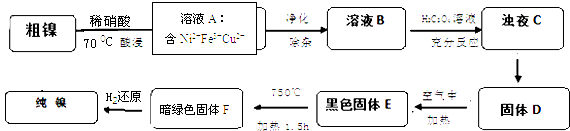
ŅŃÖŖ£ŗ
¢Ł2Ni2O3£ØŗŚÉ«£© ![]() 4NiO£ØŗŚÉ«£©+O2”ü
4NiO£ØŗŚÉ«£©+O2”ü
¢Ś
ĪļÖŹ | CuS | Cu£ØOH£©2 | Ni£ØOH£©2 | NiS |
Ksp | 8.8”Į10©38 | 2.2”Į10©20 | 5.48”Į10©18 | 3.2”Į1018 |
øł¾ŻŠÅĻ¢»Ų“š£ŗ
£Ø1£©28NiŌŚÖÜĘŚ±ķÖŠµÄµŚÖÜĘŚ£»ÄųÓėĻ”ĻõĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £® ŹµŃé±ķĆ÷ÄųµÄ½ž³öĀŹÓėĪĀ¶ČÓŠ¹Ų£¬Ėę×ÅĪĀ¶ČÉżøßÄųµÄ½ž³öĀŹŌö“󣬵«µ±ĪĀ¶ČøßÓŚ70”ꏱ£¬ÄųµÄ½ž³öĀŹÓÖ½µµĶ£¬½ž³öŌüÖŠNi£ØOH£©2ŗ¬ĮæŌö“ó£¬ĘäŌŅņĪŖ£»
£Ø2£©ŌŚČÜŅŗAµÄ¾»»Æ³żŌÓÖŠ£¬Ļȵ÷½ŚPH=5.5£¬¼ÓČČÖó·Š5min£¬¾²ÖĆŅ»¶ĪŹ±¼äŗ󣬹żĀĖ³öFe£ØOH£©3 £® ĪŖĮĖµĆµ½“æ¾»µÄČÜŅŗB»¹ŠčŅŖ¼ÓČėŅŌĻĀĪļÖŹ½ųŠŠ³żŌÓ£ØĢīÕżČ·“š°ø±źŗÅ£©£®
A.NaOH
B.Na2S
C.H2S
D.NH3©qH2O
£Ø3£©ŅŃÖŖŅŌĻĀČżÖÖĪļÖŹµÄČܽā¶Č¹ŲĻµ£ŗNiC2O4£¾NiC2O4H2O£¾NiC2O42H2O£®ÓÉ×ĒŅŗCµĆµ½¹ĢĢåDµÄ²Ł×÷°üĄØ¹żĀĖ”¢”¢£ØĢī²Ł×÷Ćū³Ę£©£» DÉś³ÉEµÄ»Æѧ·½³ĢŹ½ĪŖ
£Ø4£©1molE¾ÉĻŹöĮ÷³ĢµĆµ½“æÄų£¬ĄķĀŪÉĻ²Ī¼Ó·“Ó¦µÄĒāĘųĪŖ mol£®
£Ø5£©²ā¶Øѳʷ֊µÄÄųŗ¬ĮæµÄ»ł±¾Ė¼Ā·ŹĒ½«Ni2+×Ŗ»ÆĪŖ³Įµķ£¬Ķعż²āĮæ³ĮµķµÄÖŹĮæ½ųŅ»²½ĶĘĖćNiŗ¬Į森ŅŃÖŖNi2+ÄÜÓėCO32© £¬ C2O42©”¢S2©µČĄė×ÓŠĪ³É³Įµķ£¬µ«²ā¶ØŹ±³£Ń”Óƶ”¶žĶŖėæ£ØC4H8N2O2£©×÷³Įµķ¼Į£¬Éś³É·Ö×ÓŹ½ĪŖC8H14N4O4NiµÄĻŹŗģÉ«³Įµķ£®“ÓŹµŃéĪó²ī½Ē¶Č·ÖĪöÖ÷ŅŖŌŅņĪŖ£ŗ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®µÄדĢ¬³żĮĖĘų”¢ŅŗŗĶ¹ĢĢ¬Ķā£¬»¹ÓŠ²£Į§Ģ¬”£ĖüŹĒÓÉŅŗĢ¬Ė®¼±ĖŁĄäČ“µ½165K£ØĮćĻĀ108”ę£©Ź±ŠĪ³ÉµÄ£¬²£Į§Ģ¬µÄĖ®ĪŽ¹Ģ¶ØŠĪד£¬²»“ęŌŚ¾§Ģå½į¹¹£¬ĒŅĆܶČÓėĘÕĶØŅŗĢ¬Ė®µÄĆܶČĻąĶ¬£¬ÓŠ¹Ų²£Į§Ģ¬Ė®µÄŠšŹöÕżČ·µÄŹĒ£Ø £©
A.Ė®ÓÉŅŗĢ¬±äĪŖ²£Į§Ģ¬£¬Ģå»żĖõŠ”B.Ė®ÓÉŅŗĢ¬±äĪŖ²£Į§Ģ¬£¬Ģå»żÅņÕĶ
C.²£Į§Ģ¬ŹĒĖ®µÄŅ»ÖÖĢŲŹāדĢ¬D.²£Į§Ģ¬Ė®ŹĒ·Ö×Ó¾§Ģå
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com