
分析 (1)在同一反应中氧化剂氧化性大于还原剂还原性,氧化剂氧化性大于氧化产物氧化性判断氧化性强弱;
(2)可替代浓硫酸与硒反应生成SeO2的,应具有强的氧化性;
(3)a分析元素化合价变化,依据氧化还原反应得失电子守恒及原子个数守恒配平方程式;
b氧化还原反应中所含元素化合价升高的元素为还原剂,还原剂对应产物为氧化产物;
c反应I2+2Na2S2O3→Na2S4O6+2NaI中每消耗2mol Na2S2O3,电子转移数为2mol.
解答 解:(1)Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O,中硫酸为氧化剂,二氧化硒为氧化产物,所以氧化性H2SO4(浓)>SeO2、,2SO2+SeO2+2H2O═Se+2SO42-+4H+,反应中SeO2为氧化剂,二氧化硫为还原剂,所以氧化性SeO2>SO2,则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是:H2SO4(浓)>SeO2>SO2,
故答案为:H2SO4(浓)>SeO2>SO2;
(2)CO ②Cl2 ③硝酸 ④H2O,四种物质中氯气与硝酸具有强的氧化性,所以能够代替浓硫酸与硒反应生成SeO2,故答案为:②③;
(3)a反应①中I-失去电子生成I2,共升高2价,SeO2中+4价Se得到单质还原为单质Se,共降低4价,化合价升降最小公倍数为4,故KI的系数为4,I2的系数为2,SeO2、Se的系数都是1,KNO3的系数为4,H2O的系数为2,配平并标出电子转移的方向和数目为: ,
,
故答案为: ;
;
bI2+2Na2S2O3→Na2S4O6+2NaI,反应中硫元素化合价升高,所以Na2S4O6为氧化产物,故答案为:Na2S4O6;
c反应I2+2Na2S2O3→Na2S4O6+2NaI中每消耗2mol Na2S2O3,电子转移数为2mol,则反应②中转移的电子数为6.02×1022时,消耗的Na2S2O3的物质的量是0.1mol,质量为0.1mol×158g/mol=15.8g,故答案为:15.8.
点评 本题考查了氧化还原反应,涉及氧化还原反应方程式配平、氧化还原反应规律、氧化还原反应有关电子转移数目计算,明确氧化还原反应强弱规律、得失电子守恒规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
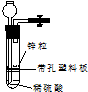 有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )
有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )| A. | ①②③ | B. | ②④⑤ | C. | ①②④⑥ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 碳酸钙跟醋酸反应CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 在碳酸氢钙溶液中加入盐酸CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、NO3-、MnO4- | B. | Mg2+、Cl-、Al3+、SO42- | ||
| C. | K+、OH-、HCO3-、NO3- | D. | K+、Na+、Fe3+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Fe3+的转化时,②中的Fe3+作氧化剂.
Fe3+的转化时,②中的Fe3+作氧化剂. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
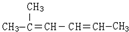 名称为:2-甲基-2,4-己二烯;
名称为:2-甲基-2,4-己二烯; ,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3
,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaO+H2O═Ca(OH)2能放出大量的热,故可通过原电池实现该反应,并把化学能转化为电能 | |
| B. | 在原电池或电解池装置中,都可实现反应:Cu+2H+═Cu2++H2 | |
| C. | 若原电池的两极是活泼性不同的两种金属,则活泼的金属不一定做负极 | |
| D. | 在钢铁制品上镶嵌锌块构成原电池以防治钢铁生锈,这种防护方法叫外加电源阴极保护法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com