

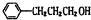 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;该反应的反应类型为酯化反应或取代反应
+H2O;该反应的反应类型为酯化反应或取代反应 .
. 分析 A是烯烃,其相对分子质量为56,B能连续被氧化生成D,则B为醇、C是醛基、D是羧酸;D分子的核磁共振氢谱上有3组峰且峰面积之比为6:1:1,A到D碳原子个数不变,结合A的相对分子质量知,D结构简式为(CH3)2CHCOOH,A结构简式为(CH3)2CH=CH2、B为(CH3)2CHCH2OH、C结构简式为(CH3)2CHCHO;
E能与银氨溶液反应,说明E中含有醛基,E被还原生成F,F分子中无甲基,1molE和1molF分别完全燃烧时,F生成的水比E的多2mol,F的不饱和度=$\frac{9×2+2-12}{2}$=4,G为一元芳香酯,则F为芳香醇,说明含有一个苯环,E结构简式为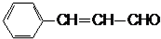 ,F结构简式为
,F结构简式为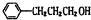 ,D和F发生酯化反应生成G,G结构简式为
,D和F发生酯化反应生成G,G结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:A是烯烃,其相对分子质量为56,B能连续被氧化生成D,则B为醇、C是醛基、D是羧酸;D分子的核磁共振氢谱上有3组峰且峰面积之比为6:1:1,A到D碳原子个数不变,结合A的相对分子质量知,D结构简式为(CH3)2CHCOOH,A结构简式为(CH3)2CH=CH2、B为(CH3)2CHCH2OH、C结构简式为(CH3)2CHCHO;
E能与银氨溶液反应,说明E中含有醛基,E被还原生成F,F分子中无甲基,1molE和1molF分别完全燃烧时,F生成的水比E的多2mol,F的不饱和度=$\frac{9×2+2-12}{2}$=4,G为一元芳香酯,则F为芳香醇,说明含有一个苯环,E结构简式为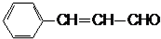 ,F结构简式为
,F结构简式为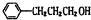 ,D和F发生酯化反应生成G,G结构简式为
,D和F发生酯化反应生成G,G结构简式为 ,
,
(1)B为(CH3)2CHCH2OH,用系统命名法命名B的名称为2-甲基-1-丙醇,E结构简式为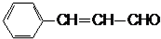 ,E中官能团的名称是碳碳双键和醛基,
,E中官能团的名称是碳碳双键和醛基,
故答案为:2-甲基-1-丙醇;碳碳双键和醛基;
(2)A的结构简式是(CH3)2CH=CH2,若在实验中只用一种试剂及必要的反应条件鉴别B、C、D,则该试剂是,D结构简式为(CH3)2CHCOOH,B为(CH3)2CHCH2OH、C结构简式为(CH3)2CHCHO,可以用新制氢氧化铜悬浊液检验,氢氧化铜和D发生中和反应、和B不反应、和C发生氧化反应生成砖红色沉淀,
故答案为:(CH3)2CH=CH2;新制氢氧化铜悬浊液;
(3)D结构简式为(CH3)2CHCOOH,F结构简式为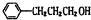 ,
,
D与F反应的化学方程式为(CH3)2CHCOOH+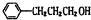 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O,该反应的反应类型为酯化反应或取代反应,
+H2O,该反应的反应类型为酯化反应或取代反应,
故答案为:(CH3)2CHCOOH+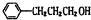 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;酯化反应或取代反应;
+H2O;酯化反应或取代反应;
(4)F为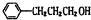 ,F的同分异构体符合下列条件:
,F的同分异构体符合下列条件:
①能与NaOH溶液反应,说明含有酚羟基;
②分子中有2个-CH3,
其取代基为-CH3、-CH2CH3和-OH,
如果-CH3、-CH2CH3相邻,有4种;
如果-CH3、-CH2CH3相间有4种,
如果-CH3、-CH2CH3相对,有2种,
如果取代基为-CH(CH3)2、-OH,有邻间对3种,
则符合条件的有13种;
其中核磁共振氢谱有5组峰的结构简式为 ,
,
故答案为:13; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合应用能力,根据某些物质结构简式、分子式结合题给信息进行推断,E结构简式的推断是易错点,难点是同分异构体种类判断,要考虑碳链异构、位置异构,题目难度中等.


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下醋酸易挥发 | |
| B. | 醋酸能与水以任意比互溶 | |
| C. | 常温下0.1mol/L的醋酸钠溶液的pH约为9 | |
| D. | 10mL0.1mol/L的醋酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA | |
| D. | 标况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C | 灼烧某白色粉末 | 火焰呈黄色 | 白色粉末中含有Na+,无K+ |
| D | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液与过量的氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 钠和硫酸铜溶液的反应:2Na+Cu2+═2Na++Cu | |
| C. | 铜与浓硝酸反应:Cu+NO3-+4H+═Cu2++NO2↑+2H2O | |
| D. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com