
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
分析 醋酸是弱酸,存在电离平衡,pH=3的盐酸和醋酸溶液中氢离子浓度相同,醋酸浓度大于盐酸的浓度,加水稀释促进醋酸电离,氢离子浓度增大抑制醋酸电离,据此分析.
解答 解:A、pH=3的盐酸和醋酸溶液中氢离子浓度相同,对水的电离的抑制作用相同,由水电离出来的c(H+)相同,故A错误;
B、pH=3的盐酸和醋酸溶液中氢离子浓度相同,醋酸浓度大于盐酸的浓度,中和相同体积的两种酸溶液所需NaOH的物质的量醋酸多于盐酸,故B错误;
C、加水稀释促进醋酸电离,盐酸和醋酸用燕馏水稀释m倍和n倍,若两溶液pH仍相同,醋酸加水稀释倍数高,所以则m<n,故C正确;
D、两溶液等体积混合,氢离子浓度不变,温度不变醋酸的电离平衡常数不变,c(CH3COO-)与c(CH3COOH)都变为原浓度的$\frac{1}{2}$,所以醋酸的电离平衡没有移动,则c(H+)=2c(CH3COO-)=2c(Cl-)>c(OH-),故D正确;
故选CD.
点评 本题考查了弱电解质的电离,明确弱电解质的电离特点即可解答,知道影响水电离的因素,知道影响弱酸电离平衡移动的因素,为易错点.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
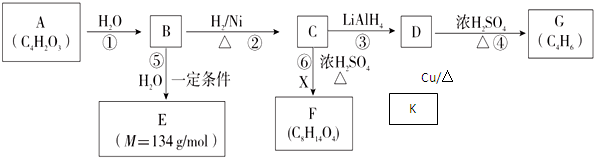
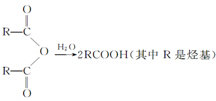 ②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基)
②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基)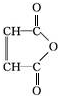 ;B中含氧官能团的名称是羧基;
;B中含氧官能团的名称是羧基;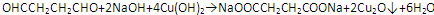
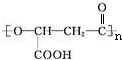 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
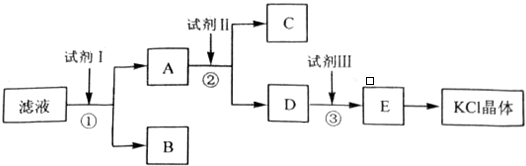
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P原子:1s2 Q原子:2s2 | |
| B. | P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子 | |
| C. | P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子 | |
| D. | P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | 28gN2和CO的混合气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | T2O与D2O | B. | 4019K与4020Ca | ||
| C. | O2和O3 | D. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1774年舍勒最早制得氯气,1820年前后漂白粉用于饮用水消毒 | |
| B. | 1869年门捷列夫发现元素周期律,使元素的性质更有规律可循 | |
| C. | 1902年哈伯开始对合成氨反应进行研究,工业化后提高了粮食产量 | |
| D. | 1942年费米进行了235U原子核裂变试验,从而开创原子能利用时代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
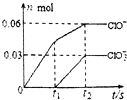 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A. | 苛性钾溶液中KOH的质量是4.94g | |
| B. | 反应中转移电子的物质的量是0.21mol | |
| C. | Cl-的物质的量为0.09mol | |
| D. | ClO${\;}_{3}^{-}$的生成是由于KOH过量引起的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com