
某晶体水溶液中加入Fe2+的溶液,再加稀硝酸溶液立即变红,另取 该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
A.KSCN B.NH4SCN
C.NH4Cl D.FeCl3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜箔制作印刷电路板:Fe3++Cu===Cu2++Fe2+
B.用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4 CaCO3+SO42-
CaCO3+SO42-
C.碳酸钠溶液显碱性:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
D.用NaOH溶液吸收氯气:Cl2+2OH—==2Cl—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学将铜片加入浓硫酸中,加热后发生反应,探究反应产生的气体产物中是否含有二氧化硫和水蒸气。
(1)写出铜跟浓硫酸在加热条件下反应的化学方程式_______________________________,其中氧化剂是____________。
(2)在上述实验中,铜和浓硫酸应放置在下列_____(填“A”、“B”或“C”)中进行反应。
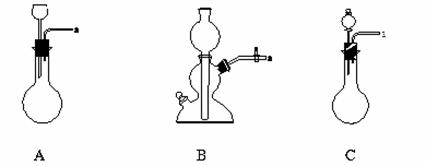
(3)将上述反应装置和下列检验装置连接,检验气体产物,连接顺序为(填连接端点的序号):a→______→______→______。
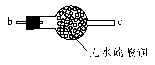

(4)酸雨是指pH小于____________的降水。由二氧化硫形成的酸雨中含一种强酸,该酸是______________,这种酸雨形成过程中的氧化剂是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的的是
A.向氯化铝溶液中滴加过量氨水,最终得到澄清溶液
B.用互相滴加的方法可鉴别氯化铝溶液、氢氧化钠溶液
C.常温下铝与浓硝酸反应制得大量的NO2
D.AlCl3溶液加热蒸干得到无水氯化铝晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
一种高效无机水处理剂——聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m。它可通过调节AlCl3溶液的pH,促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
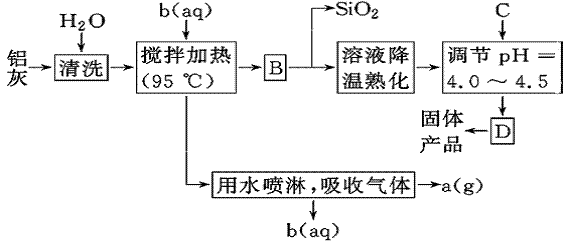
(1)搅拌加热操作过程中发生反应的离子方程式为________________________________。
(2)生产过程中实验操作B、D的名称均为________。
(3)反应中副产品a是________,试剂b是________。(用化学式表示)
(4)生产过程中可循环使用的物质是________(用化学式表示)。
(5)调节pH=4. 0~4.5的目的是_________________________________________。
0~4.5的目的是_________________________________________。
(6)为得到较纯净的晶体,生产过程中C物质可选用________。
A.氨水 B.NaAlO2 C.NaOH
D.Al2O3 E.Al
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀溶液中含有F e(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
e(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
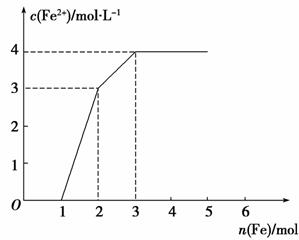
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子为( )
A.0.1 mol B.0.2 mol
C.0.3 mol D.0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铁及其化合物的说法中正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤
D.Fe3+与KSCN产生红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com