
ij�¶��£���֪����ĵ��볣��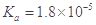 �����������ܶȻ�
�����������ܶȻ�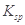 (CH3COOAg )=1.6��10
(CH3COOAg )=1.6��10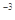 ,
,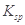 (Ag2CO3)="8.3"
(Ag2CO3)="8.3" 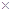 l0
l0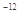 ���ڲ���������ˮ�������£������й�˵����ȷ����
���ڲ���������ˮ�������£������й�˵����ȷ����
A������ˮ��Һ��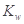 ���䣬�ʴ����ˮ�ĵ�����Ӱ�� ���䣬�ʴ����ˮ�ĵ�����Ӱ�� |
| B�����¶��±��ʹ���ˮ��Һ��pH =5-lgl.8 |
C�����¶���Ũ�Ⱦ�Ϊ0.01 mol ��CH3COONa��Һ��AgNO3����Һ�������ϣ������Һ������мӺ��ԣ�����CH3COOAg�������� ��CH3COONa��Һ��AgNO3����Һ�������ϣ������Һ������мӺ��ԣ�����CH3COOAg�������� |
D����0.02 mol ��Na2CO3����Һ��CH3COOAg��������Һ�������ϣ����ְ�ɫ���� ��Na2CO3����Һ��CH3COOAg��������Һ�������ϣ����ְ�ɫ���� |
D
�������������Aˮ��������ʣ����ڵ���ƽ��H2O H++OH-������ˮ�м���CH3COOHʱ��������������H+ʹ��Һ�е�H+Ũ������ˮ�ĵ���ƽ�������������á�����B.PHΪ��Һ��c(H+)�ĸ�������
H++OH-������ˮ�м���CH3COOHʱ��������������H+ʹ��Һ�е�H+Ũ������ˮ�ĵ���ƽ�������������á�����B.PHΪ��Һ��c(H+)�ĸ�������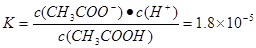 .
. ;
;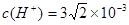 .����pH="3-" lg
.����pH="3-" lg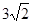 ������C.�����ߵ������ϣ���c(CH3COO-)��c(Ag+)=" 0.005mol/L��0.005mol/L=" 2.5��10-5 mol2/L2 <1.6��10-3=���������ܶȻ�Ksp (CH3COOAg ).��˲�����CH3COOAg�������ɡ�����D������0.02 mol/L��Na2CO3��Һ��CH3COOAg��������Һ�������ϣ�c(CO32-)="0.01mol/L;" c(Ag+)=" 1/2��4" ��10-2 mol/L=2��10-2mol/L. c(CO32-)��c(Ag+)2=0.01mol/L��(2��10-2mol/L)2=4��10-6mol3/L3>8.3 ��l0-12.��˻����Ag2CO3��ɫ��������ȷ��
������C.�����ߵ������ϣ���c(CH3COO-)��c(Ag+)=" 0.005mol/L��0.005mol/L=" 2.5��10-5 mol2/L2 <1.6��10-3=���������ܶȻ�Ksp (CH3COOAg ).��˲�����CH3COOAg�������ɡ�����D������0.02 mol/L��Na2CO3��Һ��CH3COOAg��������Һ�������ϣ�c(CO32-)="0.01mol/L;" c(Ag+)=" 1/2��4" ��10-2 mol/L=2��10-2mol/L. c(CO32-)��c(Ag+)2=0.01mol/L��(2��10-2mol/L)2=4��10-6mol3/L3>8.3 ��l0-12.��˻����Ag2CO3��ɫ��������ȷ��
���㣺�������ƽ�⡢ˮ��ƽ�⡢�����ܽ�ƽ���֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ���ǣ� ��
| A��NaHCO3��Һ��ˮϡ�ͣ�c(Na+)/c(HCO3��)�ı�ֵ�������� |
| B��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ��2c(Na��)��3[c(CO32��)��c(HCO3��)] |
| C���ڸ��������Һ�У�H+��K+��SO42���������Ƿ��ӿ��Դ������� |
| D����֪��Ksp(AgCl)��1.8��10��10�� Ksp(Ag2Cr2O4)��2.0��10��12����Ag2CrO4���ܽ��С��AgCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�Ũ�Ⱦ�Ϊ0.1000 mol / L������һԪ��HX��HY��HZ���ֱ���0. 1000 mol/ L��NaOH��Һ���еζ����ζ�������ͼ��ʾ�������й�������ȷ����
| A��NaOH��Һ��������ķ�Ӧ�������ȷ�Ӧ |
| B���ζ���HY���÷�̪��ָʾ�� |
| C������ǿ����HX>HY>HZ |
| D���ζ������ᶼ���ü�����ָʾ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��100mL 1mol��L-1��Na2CO3��Һ������˵������ȷ����
A������Һϡ�ͣ�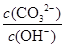 ���� ���� |
| B�����˺�0.l mol CH3COOH����Һ:c ( CH3 COOһ)��c( HCO3һ) |
| C��ͨ��0.1 mo1CO2���壬��Һ�д���:c ( Na+)��c( CO32һ)ʮc( HCO3һ)+c(H2CO3) |
| D�����˷�̪���ȣ���Һ��ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���л����Һ�У�������Ũ�ȵĴ�С��ϵ����ȷ���ǣ� ��
| A�����ʵ���Ũ�����CH3COOH��CH3COONa��Һ�������ϣ� c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B��0.1 mol/L Na2CO3��Һ��c(OH��)��c(HCO3��)��c(H��)��c(H2CO3) |
| C�����ʵ���Ũ�����Na2CO3��NaHCO3��Һ�������ϣ�����Ũ�ȵĴ�С˳���� c (Na+)>c (HCO3-)> c(CO32��)>c(OH-)> c(H��) |
| D��NH4Cl��Һ�У�c(H+) = c(NH3��H2O) +c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ����a mol��L-1�İ�ˮ��b mol��L-1�������������(��Ϻ���Һ���Ϊ���ǰ����Һ�����֮��)�����������������
| A�������Һ������ʾ���ԡ����Ի����� |
| B�������Һ��һ������c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C����a>b��������Һ��c(C1-)=c(NH4+)+c(NH3��H2O) |
D���������Һ�����ԣ���NH3��H2O�ĵ���ƽ�ⳣ��Ϊ mol��L-1 mol��L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ȷ����(����)
| A��ij������Һ��pH��a��������Һϡ��10������Һ��pH��b����a��b��1 |
| B���ڵ��з�̪��Һ�İ�ˮ�У�����NH4Cl����Һǡ����ɫ�����ʱ��Һ��c(NH4+) �� c(Cl��) |
| C��25�� 0.5��10��3 mol/L�����pH��3.0�������¶���ҺpH���� |
| D��100��ʱ��KW��10��12����pH��1��������pH��11 NaOH��Һ��Ϻ���Һ��pH��6����������NaOH��Һ�����Ϊ1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����(����)��
A��0.1 mol��L��1�Ĵ�����Һ��ˮϡ�ͣ�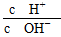 ��С ��С |
| B�������pH����ͬ�Ĵ����������ȫ�ܽ������þ��(����)��������ʱ�� |
| C����ˮ�м������������������ƣ�c(H��)����KW��� |
| D�������£�V1 L pH��11��NaOH��Һ��V2 L pH��3��HA��Һ��ϣ������Һ�����ԣ���V1��V2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ���ǣ�������
| A��ˮ�����ӻ�����KWֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶� |
| B��Ksp���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й� |
| C�������£���0.10 mol��L��1��NH3��H2O��Һ�м�������NH4Cl���壬��ʹ��Һ��pH��С��c��NH4+��/c��NH3��H2O����ֵ���� |
| D�������£�CH3COOH��KW��1.7��10��5��NH3��H2O��Kb��1.7��10��5��CH3COOH��Һ�е�c��H������NH3��H2O�е�c��OH������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com