
【题目】下列关于晶体的说法一定正确的是( )

(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
科目:高中化学 来源: 题型:
【题目】将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸不变蓝色的有( )
A.加热浓氨水
B.加热NH4HCO3固体
C.加热NH4Cl和Ca(OH)2的混合物
D.加热饱和NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是

A. 氧化剂与还原剂的物质的量之比为3:1
B. 该过程中涉及极性键和非极性键的断裂与生成
C. 基于![]() 合成
合成![]() 的过程属于氮的固定
的过程属于氮的固定
D. 工业中,氨经一系列反应可以得到硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。

(1)元素Ga在元素周期表中的位置为:___(写明周期和族)。
(2)Sn的最高正价为___,Cl的最高价氧化物对应水化物的化学式为___,As的气态氢化物为___。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se
B.In的金属性比Se强
C.In的金属性比Al弱
D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___。
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的最外电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是

A. 1mol d的氧化物含2mol 化学键
B. 工业上电解c的氧化物冶炼单质c
C. 原子半径:a < b < c < d
D. 简单氢化物的沸点:a < d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)用双线桥法表示电子转移方向和数目_____:①MnO2 +4HCl(浓)=== Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为__(填化学式),被氧化的物质的量为 _____,同时转移电子数为_____。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_____L,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。(已知:H2+Cl2![]() 2HCl)
2HCl)
(4)②KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2 ![]() 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到_____g固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究SO2的化学性质,设计了如图系列实验。

(1)①中开始时无现象,放置一段时间后,出现白色浑浊,写出有关的三个反应的化学方程式:___、___、___;
(2)③中发生反应后的铁元素的价态为___。
(3)试写出④⑤中反应的离子方程式:___、___。
(4)若通入的气体改为CO2,那么①②③④中哪个会出现与SO2不同的现象?___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
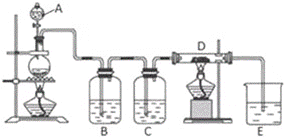
(1)仪器A的名称是____,烧瓶中反应的化学方程式是____。其中盐酸具有___(填序号)
①氧化性 ②还原性 ③酸性
(2)装置B中盛放液体是___,气体通过装置B的目的是___。装置C中盛放的液体是___。
(3)D中反应的化学方程式是____。
(4)烧杯E中盛放的液体是___,作用是___,反应的离子方程式是___。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加___装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
A.  B.
B. 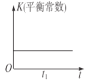 C.
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com