
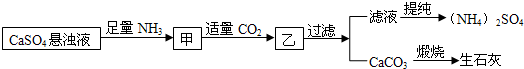
| A、生成1mol (NH4)2SO4至少消耗2mol NH3 |
| B、CO2可被循环使用 |
| C、先通二氧化碳,后通氨气,效果相同 |
| D、往甲中通CO2有利于制备(NH4)2SO4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、饱和溶液的物质的量浓度为c=
| ||
B、25℃时R的溶解度为S=
| ||
C、饱和溶液中溶质的质量分数为W=
| ||
D、饱和溶液的密度为ρ=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸和澄清石灰水的反应 |
| B、盐酸和氢氧化镁的反应 |
| C、硫酸和氢氧化钡的反应 |
| D、盐酸和氨水的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用一束激光照射胶体和溶液都有光亮的通路 |
| B、制备氢氧化铁胶体时加入的饱和氯化铁溶液越多越好 |
| C、用过滤的方法不能分离氢氧化铁胶体和氯化铁溶液 |
| D、向氢氧化铁胶体中加入过量盐酸后出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com