
| A. | 112号元素是金属元素 | |
| B. | 112号元素位于第七周期,是主族元素 | |
| C. | ${\;}_{112}^{277}$R原子中子数为165 | |
| D. | 112号元素为放射性元素 |
分析 112号元素的原子(${\;}_{112}^{277}$R),该元素原子结构示意图为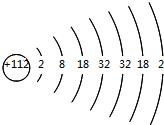 ,根据其原子结构示意图知,该元素位于第7周期第IIB族,其中子数=质量数-中子数,据此分析解答.
,根据其原子结构示意图知,该元素位于第7周期第IIB族,其中子数=质量数-中子数,据此分析解答.
解答 解:112号元素的原子(${\;}_{112}^{277}$R),该元素原子结构示意图为 ,
,
A.112号元素位于第7周期第IIB族,属于金属元素,故A正确;
B.112号元素位于第7周期第IIB族,属于过渡元素,不是主族元素,故B错误;
C.${\;}_{112}^{277}$R原子中子数=277-112=165,故C正确;
D.112号元素为放射性元素,故D正确;
故选B.
点评 本题考查了原子结构和元素在周期表中的位置,熟悉元素周期表结构是解本题关键,根据元素在周期表中的位置确定其性质,知道质量数、中子数、质子数的关系,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温高压 | B. | 低温低压 | C. | 高温高压 | D. | 使用合适催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏是物理变化 | |
| B. | 煤的气化和液化主要目的是为了获得较洁净的能源 | |
| C. | 汽油主要来自石油的裂解 | |
| D. | 乙烯是来自石油的裂化和裂解的重要化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装 置 | 现 象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 | |
| Ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装置 | 现象 |
 | Ⅰ.实验初始,未见明显现象 |
| Ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com