
 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:分析 (1)根据浓盐酸和二氧化锰的性质判断生成物,从而确定方程式,根据元素的化合价的变化判断是否是氧化还原反应;
(2)根据浓盐酸的性质及反应方程式确定混合气体的成分,根据氯化氢的性质判断饱和食盐水(或水) 的作用;
(3)根据题目要求结合反应方程式中的生成物判断C处盛放的试剂及作用;
(4)根据氯气的性质确定尾气处理装置中物质;
(5)根据防止倒吸解答;
(6)只有浓盐酸才与二氧化锰反应,稀盐酸不反应.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O,反应中氯化氢被氧化成氯气,反应是氧化还原反应,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O;是;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢;氯化氢极易溶于水,氯气的溶解度较小.所以可用盛有饱和食盐水(或水)除去混合气体中的氯化氢,
故答案为:除去Cl2中的HCl;
(3)因为题中要求制取纯净的无水CuCl2,所以要除去氯气中混有的水蒸气,且不引进新的杂质、氯气也和该物质不反应,所以该物质起干燥作用,
故答案为:浓硫酸;干燥Cl2;
(4)氯气有毒,所以不能直接排空,氯气和水能反应生成酸,酸和碱反应,所以可用碱液吸收氯气,氯气和碱反应生成盐、次氯酸盐、水,
故答案为:氢氧化钠溶液;Cl2+2OH-=Cl-+ClO-+H2O;
(5)为防止倒吸应先熄灭D的酒精灯,冷却再熄灭A的酒精灯,故答案为:D;
(6)反应过程中浓盐酸部分挥发,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气,若用200mL 10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.56mol,原因是 随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,故应小于0.5mol,
故答案为:小于; 随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,故应小于0.5mol.
点评 本题考查了氯气的制备和性质的检验,熟悉氯气制备原理及反应装置特点即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: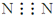 | |
| B. | 乙酸乙酯的结构简式:C4H8O2 | |
| C. | O2-的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、Ba2+、Cl-、NO3- | |
| B. | Pb2+、Hg2+、S2-、SO42- | |
| C. | 0.1mol/L的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| D. | 0.1mol/L Na2CO3的溶液中:K+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含质子数相等 | |
| C. | 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等 | |
| D. | 12g C和16g O所含的原子数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的100gNa2O2与CO2反应后,固体质量变成了105.6g,此反应转移电子为0.4mol | |
| B. | 在Fe与含nmolHNO3的稀溶液反应中,被还原的HNO3不一定为$\frac{1}{4}$nmol | |
| C. | 在Mg与Al做电极,其它溶液做电解质构成原电池中,Mg一定为负极 | |
| D. | 碱性氧化物一定为金属氧化物,酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com