
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)═c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
分析 A、0.1mol•L-1NaHC2O4溶液的pH=5.5,说明草酸氢根离子的电离程度大于水解程度;
B、据NaHS溶液中物料守恒和电荷守恒进行判断;
C、相同浓度的醋酸和醋酸钠混合溶液显酸性,据此分析;
D、溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分.
解答 解:A、在NaHC2O4溶液中,草酸氢根离子的电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故A错误;
B、根据物料守恒可得:c(Na+)=c(HS-)+c(H2S)+c(S2-),根据电荷守恒可知:c(H+)+c(Na+)=2c(S2-)+c(OH-)+c(HS-),由电荷守恒和物料守恒联立可得:c(OH-)+c(S2-)═c(H+)+c(H2S),故B正确;
C、相同浓度的醋酸和醋酸钠混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故C错误;
D、溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,此时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选BD.
点评 本题考查盐类的水解、电解质溶液中的电荷守恒和物料守恒以及离子浓度大小的比较,题目难度中等,D为易错点,注意根据守恒思想解题.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.| 乙醇 | 四氯化碳 | 碘(晶体) | |
| 密度/g•cm-3 | 0.7893 | 1.595 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 184.35 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
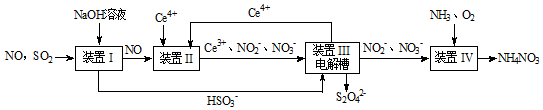
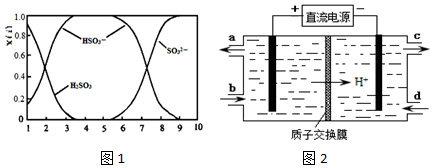
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个甲基,能生成4种-氯代物 | B. | 3个甲基,能生成5种-氯代物 | ||
| C. | 3个甲基,能生成9种-氯代物 | D. | 4个甲基,能生成4种-氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 2.00 | 3.00 |
| t1 | 0.80 | |
| t2 | 1.80 |
| A. | 用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{0.60}{t_1}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol | |
| C. | 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 | |
| D. | 温度升至T2 K,上述反应的平衡常数为0.70,则正反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
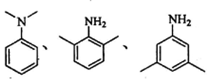
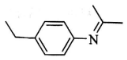 )有广泛应用.合成G的一种路径如图.1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.
)有广泛应用.合成G的一种路径如图.1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.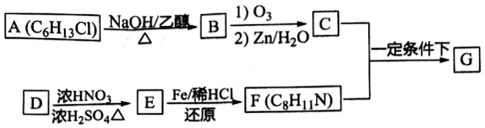
 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+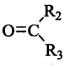
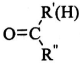 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O
+H2O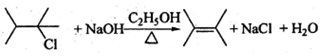 .
. .
.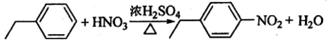 .
. .
.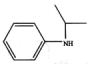 )的合成路线(流程图表示,无机试剂任选)
)的合成路线(流程图表示,无机试剂任选)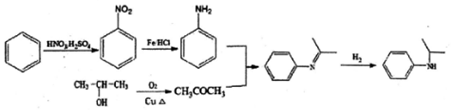 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 易溶于水 | |
| B. | 一氯代物有5种 | |
| C. | 最多能与氢气以物质的量之比1:4加成 | |
| D. | 碱性水解的产物之一是1-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 丙烷和2-甲基丙烷的一氯代物均为两种 | |
| C. | 油脂发生皂化反应能生成甘油 | |
| D. | 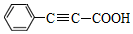 是高分子化合物 是高分子化合物 的单体 的单体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com