
【题目】科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料,空气为氧化剂,电解质是固态氧化物,在熔融状态下能传导O2﹣; 该电池的总反应是C3H8+5O2═3CO2+4H2O,负极反应为C3H8﹣20e﹣+10O2﹣═3CO2+4H2O.下列关于该燃料电池的说法中正确的是( )
A.在熔融电解质中,O2﹣由负极移向正极
B.电池的正极通入丙烷
C.电路中每通过5 mol 电子,约有5.6 L标准状况下的丙烷被完全氧化
D.在电池正极的电极反应为O2﹣4e﹣═2O2﹣
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
物质 | 杂质 | 除杂质所用试剂和方法 | |
A | FeCl3 | FeCl2 | 加入足量的Fe粉,过滤 |
B | CO2 | HCl | 通入饱和Na2CO3溶液,洗气 |
C | SO2 | H2O | 通入浓硫酸,洗气 |
D | Mg | Cu | 加入浓硫酸,过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,纯水中c(H+)=2×10﹣7 molL﹣1 , 则此温度下水的离子积为 . 若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 molL﹣1 , 则此时c(OH﹣)= . 由水电离产生的c(H+)为 , 此时温度(填“高于”、“低于”或“等于”)25°C.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.单质分子中不一定有化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据海水综合利用的工业流程图,判断下列说法不正确的是( )

A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度看,氯碱工业电解饱和食盐水是一个将电能转化为化学能的过程
D. 从第④步到第⑤步的目的是富集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1 mol·L-1NH4Cl溶液加水稀释,![]() 的值减小
的值减小
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的用量被视为一个国家工业发达水平的一种标志。反应2SO2+O2![]() 2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
A. 该反应为可逆反应,在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B. 达到平衡后,反应就停止了,正、逆反应速率相等且都为零
C. 在利用上述反应生产三氧化硫时,要考虑适当增大化学反应速率
D. 在利用上述反应生产三氧化硫时,要考虑使尽可能多的二氧化硫转化为三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:
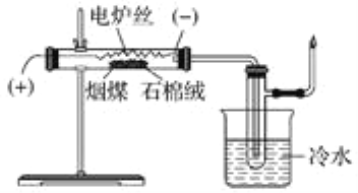
(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究SO2使品红溶液褪色的过程,将SO2通入水中得到pH=2的溶液A,后续操作如下,下列说法不正确的是
实验1 |
|
实验2 |
|
A. 溶液A的pH=2原因是:SO2 + H2O![]() H2SO3
H2SO3 ![]() H+ + HSO3-
H+ + HSO3-
B. 实验1、实验2均体现了SO2的还原性和漂白性
C. 经实验1、2对比可知品红溶液褪色的过程是可逆的
D. 实验2中加入NaOH溶液调节pH =2 的原因是排除H+浓度变化产生的干扰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com