
已知氢氟酸在水溶液中建立如下电离平衡:HF⇌H++F﹣,如只改变一个条件一定可以使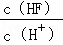 减小的是( )
减小的是( )
|
| A. | 通氯化氢气体 | B. | 加入少量氟化钾固体 |
|
| C. | 加入少氢氧化钠固体 | D. | 通入少量氟化氢气体 |
| 弱电解质在水溶液中的电离平衡.. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | 只改变一个条件一定可以使c(HF)/c(H+)减小,即分式中分母增大,或分子减少,也可利用电离平衡正向移动来分析. |
| 解答: | 解:A、通氯化氢气体,溶液中的c(H+)增大,化学平衡虽逆向移动,但c(H+)增大的程度大于c(HF)增大的程度,则c(HF)/c(H+)减小,故A正确; B、加入少量氟化钾固体,氟离子的浓度增大,化学平衡逆向移动,c(HF)增大,c(H+)减小,则c(HF)/c(H+)增大,故B错误; C、加入少氢氧化钠固体,氢离子的浓度减小,化学平衡正向移动,但c(HF)大于c(H+),则c(HF)/c(H+)增大,故C错误; D、通入少量氟化氢气体,化学平衡虽正向移动,但c(HF)增大的程度大于c(H+)增大的程度,则c(HF)/c(H+)增大,故D错误; 故选A. |
| 点评: | 本题考查电离平衡的移动,明确影响电离平衡移动的因素是解答的关键,并注意加入某物质或某离子时该物质或离子的浓度相对增大的程度更大来解答. |


科目:高中化学 来源: 题型:
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是 ( )
A.c(SO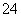 )>c(NH
)>c(NH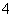 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(SO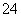 )=c(NH
)=c(NH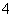 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
C.2c(SO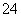 )+c(OH-)=c(NH
)+c(OH-)=c(NH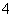 )+2c(Fe2+)+c(H+)
)+2c(Fe2+)+c(H+)
D.c(H+)=c(OH-)+c(NH3·H2O)+2c[Fe(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说 法正确的是:
法正确的是:
A.每生成1 mol N2转移的电子的物质的量为6 mol
B.N2既是氧化剂,又是还原剂
C.NH4Cl中的氮元素被还原
D.NaNO2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
主族元素单质及化合物在许多性质上都存在着递变规律.下列有关说法不正确的是( )
|
| A. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
|
| B. | 氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
|
| C. | 氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
|
| D. | 最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用质量均为100g的Cu作电极,电解AgNO3溶液.稍电解一段时间后,两电极的质量相差28g,此时两电极的质量分别为( )
|
| A. | 阳极100 g,阴极128 g | B. | 阳极93.6 g,阴极121.6 g |
|
| C. | 阳极91.0 g,阴极119.0 g | D. | 阳极86.0 g,阴极114.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图所示)在保持400℃的条件下使之发生如下反应:2SO2+O2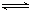 2SO3.则下列描述正确的是( )
2SO3.则下列描述正确的是( )
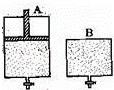
|
| A. | 达到平衡所需要的时间:A容器更短 |
|
| B. | 达到平衡时:B容器中SO3的转化率更大 |
|
| C. | 达到平衡时:A容器中SO2的物质的量更多 |
|
| D. | 达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大,B容器中SO3的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视,所以“低碳经济”正成为科学家研究的主要课题.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡梁/mol | 达到平衡所需时间/nin |
| |
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 .(精确到0.01,下同)
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= .
(2)以二甲醚(CH3OCH3)、空气、氢氧化钾为原料,铂为电极可构成燃料电池,其工作原理 与甲烷燃料电池的原理相似.请写出该电池负极上的电极反应式: .
(3)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为﹣285.8kJ•mol﹣1、﹣283.0kJ•mol ﹣1和﹣726.5kJ•mol﹣1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体 g.
(3)称量.①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置:
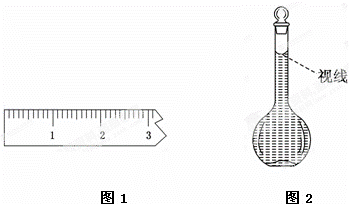
②称量过程中NaCl晶体应放于天平的 (填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用 引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、 、 .
(8)在配制过程中,某学生观察定容时液面情况如图2所示,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项表述正确的是( )
A.氢氧化钡的电离方程式为Ba(OH)2=Ba2++2OH-
B.强弱电解质的本质区别是溶液的导电性强弱。
C.电解质与非电解质的本质区别是水溶液能否导电;
D.硫酸氢钠是强电解质,碳酸氢钠是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com