
分析 (1)硫燃烧生成刺激性气味二氧化硫,火焰为淡蓝色;
(2)二氧化硫具有还原性,能被酸性高锰酸钾氧化;
(3)A为二氧化硫和氧气反应生成的物质,可判断A为三氧化硫;
(4)反应④是硫酸和氯化钡溶液反应生成硫酸钡沉淀和盐酸.
解答 解:(1)①为硫的燃烧,硫在空气里燃烧发出淡蓝色火焰,放出大量的热,还能闻到刺激性气味;
故答案为:发出淡蓝色火焰,放出大量的热,生成刺激性气味的气体;
(2)二氧化硫具有还原性,能被酸性高锰酸钾氧化,反应为5SO2+2KMnO4KMnO4+2H2O═K2SO4 +2MnSO4+2H2SO4,即SO2能使酸性高锰酸钾溶液褪色,是因为它具有还原性,
故答案为:还原性;
(3)A为二氧化硫和氧气反应生成的物质,可判断A为三氧化硫,其化学式为SO3;
故答案为:SO3;
(4)反应⑤是硫酸和氯化钡溶液反应生成硫酸钡沉淀和盐酸,反应的离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查了硫及其化合物性质的分析判断,侧重于基础知识的考查,注意二氧化硫漂白性、还原性的辨别,本题难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分为硅单质 | |
| B. | Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 | |
| C. | Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 | |
| D. | 制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-b}{a}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{2a-b}{a}$ | D. | $\frac{2a-b}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2FeCl2═2FeCl3 | D. | 3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
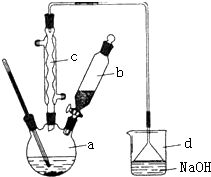 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com