
 �ɶ����ڳ���Ԫ���γɵĴ�����A��B��C��D��E��F��Xת����ϵ��ͼ��ʾ��ijЩ��������ȥ����
�ɶ����ڳ���Ԫ���γɵĴ�����A��B��C��D��E��F��Xת����ϵ��ͼ��ʾ��ijЩ��������ȥ����
| ||
| ||


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��̼һ12 ��ԭ�ӷ��ţ�612C |
B���ǻ��ĵ���ʽ��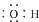 |
| C���ȷµĻ�ѧʽ��CCl4 |
D���״��Ľṹʽ��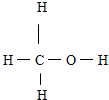 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��28.4 |
| B��28.4g?mol-1 |
| C��71 |
| D��71g?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��
| ||
B��
| ||
C��
| ||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������ܷų���������Һ��Na+��Cl-��SO42-��Fe3+ |
| B��ʹ��ɫʯ����Һ������Һ��Fe2+��Mg2+��NO3-��Cl- |
| C��c��OH-��=10-12 mol?L-1����Һ��K+��Ba2+��Cl-��Br- |
| D���ں��д���AlO2-����Һ�У�NH4+��Na+��Cl-��H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �л���A��һ����Ҫ�����������м��壬��ṹ��ʽΪ��
�л���A��һ����Ҫ�����������м��壬��ṹ��ʽΪ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2012��10���㽭ʡ�״������Ե�������ɣ�Ϊ�㽭ʡ�״����͵Ľ�һ���ƹ�Ӧ������������93��������ȣ��״�����ÿ��Լ����0.5Ԫ-0.6Ԫ����֪���³�ѹ�£�1mol�״���CH3OH�����۵�-97.8�桢�е�64.5�棩�ڿ�������ȫȼ������Һ̬ˮʱ���ų�QkJ����������ش�����������⣺
2012��10���㽭ʡ�״������Ե�������ɣ�Ϊ�㽭ʡ�״����͵Ľ�һ���ƹ�Ӧ������������93��������ȣ��״�����ÿ��Լ����0.5Ԫ-0.6Ԫ����֪���³�ѹ�£�1mol�״���CH3OH�����۵�-97.8�桢�е�64.5�棩�ڿ�������ȫȼ������Һ̬ˮʱ���ų�QkJ����������ش�����������⣺| Q |
| 32 |
| Q |
| 16 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A�����л���ķ���ʽ��C15H27O4N4 |
| B���÷����к��а������Ȼ����ǻ���ȩ���ȹ����� |
| C���÷��Ӳ����������ԣ����ܷ���ˮ�ⷴӦ��������Ӧ |
| D���÷����к���6������̼ԭ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com