
【题目】对于反应mA(s) + nB(g) ![]() eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是

A. 化学方程式中n<e +f
B. 达到平衡后,若升温,v正减小,v逆增大
C. 达到平衡后,增加B的量,B的转化率增大
D. 若B为有色物质,达到平衡后缩小容器体积,重新达平衡后与原平衡比较气体颜色变浅
【答案】C
【解析】
首先看趋势,随着压强的增大,C%逐渐增大;说明增大压强,平衡正向移动,根据所学增大压强,化学平衡向气体体积减小的方向移动,则n>e+f。固定压强不变,可以知道随着温度的升高,C%降低,说明升高温度,平衡逆向移动;根据所学,升高温度向吸热反应方向移动,逆反应为吸热反应,则正反应为放热反应。
A.随着压强的增大,C%逐渐增大;说明增大压强,平衡正向移动,根据所学增大压强,化学平衡向气体体积减小的方向移动,则n>e+f;A项错误;
B.升高温度,不管是正反应速率还是逆反应速率均加快,B项错误;
C.由于A是固体,所以增加B的量,为等比例的加入反应物,从等效平衡的角度思考。加入反应B后,平衡效果相当于加压,增大压强向气体体积减小的方向移动,气体体积减小的方向为正反应方向,B的转化率增大,C项正确;
D.若B为有色物质,达到平衡后缩小容器体积,虽然平衡正向移动,但是新平衡中B的浓度比原平衡的大,颜色会加深,D项错误;
本题答案选C。


科目:高中化学 来源: 题型:
【题目】关于如图装置中的变化叙述错误的是

A.电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片
B.铜片上发生氧化反应
C.右侧碳棒上发生的反应:2H++2e→H2 ↑
D.铜电极出现气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.SiO2既能和NaOH溶液反应,又能和HF反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以H2SiO3的酸性比H2CO3强
Na2SiO3+CO2↑,所以H2SiO3的酸性比H2CO3强
C.CO2和SiO2都能与C反应
D.CO2和SiO2都是酸性氧化物,所以两者物理性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 四种物质有如下相互转化关系(其中 Y、Z 为化合物,未列出反应条件)。
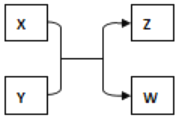
(1)若实验室经常用澄清石灰水来检验 X 的燃烧产物,W 的用途之一是计算机芯片,W 在周期表中的位置为 ___________,Y 的用途有 _________,写出Y与NaOH 溶液反应的离子方程式 _________。
(2)若 X、W 为日常生活中常见的两种金属,且 Y 常用作红色油漆和涂料,则该反应的化学方程式为___________。
(3)若 X 为淡黄色粉末,Y 为生活中常见液体,则:
①X 的电子式为 _______________,该反应的化学方程式为 ____________,生成的化合物中所含化学键类型有 ________________________。
② 若 7.8 克 X 物质完全反应,转移的电子数为 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72 L CH4;②3.01×1023个HCl分子;③7.2 g H2O,下列对这三种物质的关系从小到大的排列顺序是:
(1)物质的量______;
(2)体积______;
(3)质量______;
(4)氢原子数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.纯净的水晶是由硅原子和氧原子构成的,每个原子的最外层均具有8电子稳定结构
B.Na2O是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有共价键的形成
C.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
D.NH5中所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既含有离子键又含有共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(只含MnO2和MnO)、H2SO4(过量)和FeS2制备MnSO4·H2O的流程如下(已知流程中的FeS2、FeSO4、MnO2、MnO均完全反应):
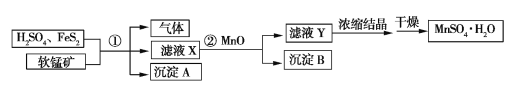
(1)已知①中只有三个反应,其中两个反应是
MnO+H2SO4MnSO4+H2O
FeS2+H2SO4FeSO4+H2S↑+S↓
完成第三个反应:
___MnO2+___FeSO4+___ ____________MnSO4+___ _________+___ _________
(2)沉淀A、B的化学式分别是____________________、__________________。
(3)滤液X中的溶质有__________;实验室中浓缩滤液Y时使用的玻璃仪器有___________________。
(4)若得到的沉淀A的质量和MnSO4·H2O的质量分别为96.0 g、321.1 g,②中加入的MnO为0.1 mol,则理论上软锰矿中MnO2和MnO的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____,同周期元素中基态原子与镍具有相同未成对电子的还有____种。
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___三种组成元素按电负性由大到小的顺序为____。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____,写出与SO42-互为等电子体的一种分子和一种离子的化学式____,____;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____体空隙中,其空隙的填充率为____。
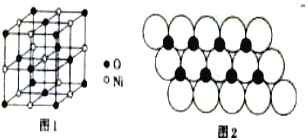
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___g。(用a、NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com