
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族。W 与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5 倍。下列叙述中不正确的是
A.WZ2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X <W<Y<Z
科目:高中化学 来源: 题型:
某混合溶液中可能含有下列离子中的若干种:NH+ 4、Na+、Al3+、Fe2+、Fe3+、AlO- 2、SO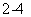 、I-、NO
、I-、NO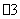 、CO
、CO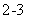 ,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生;(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。根据上述实验情况,以下说法错误的是( )。
,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生;(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。根据上述实验情况,以下说法错误的是( )。
A.该混合溶液中一定不含有Fe3+、AlO- 2、Al3+、CO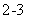
B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
C.该混合溶液中肯定含有Fe2+、NH4+、SO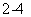 、NO
、NO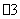
D.向该混合溶液中滴加酚酞试液后呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.1 mol 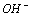 的质量为18g/mol
的质量为18g/mol
B.CO2 的摩尔质量为44g
C.任何物质的摩尔质量等于它的相对原子质量或相对分子质量
D.一个钠原子的质量约等于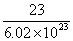 g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实方案
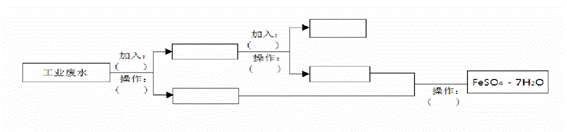
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素,核电荷数依次增加。只有E为金属,A与E同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两对成对电子。E+与C3-具有相同的电子层结构。请回答下列问题:
(1)F的价电子排布为______。
B、F形成的化合物晶体类型是_____。
(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式为______。
(3)A、C形成的分子有_____对孤对电子、_____个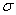 键,中心原子杂化方式为______。
键,中心原子杂化方式为______。
(4)稳定性:CA3_____FA4。离子半径:E+_______C3-。(填“>”或“<”
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件下,离子能大量共存或者离子方程式正确的是
A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42-
B.在含较多Al3+的溶液中:K+、Cl-、HCO3-
C.NH4HSO4溶液与过量NaOH稀溶液反应:NH4+ +OH-=NH3·H2O
D.向小苏打溶液中加入NaOH固体:HCO3- + OH-=CO32- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH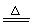 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。请完成FeO42-与水反应的方程式:4FeO42-+10H2O  4Fe(OH)3+8OH-+( )
4Fe(OH)3+8OH-+( )
(3)K2FeO4在处理水的过程中能消毒杀菌是因为① ,
它能净水的原因是② 。
(4) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
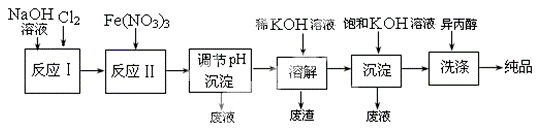
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的Cl-浓度与100 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是
A.200 mL 1 mol·L-1 KCl溶液 B.50 mL 2 mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 NaCl溶液 D.50mL 1 mol ·L-1 AlCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com