
| A. | 铁表面镀铜,表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 铁丝与浓硫酸在常温下钝化 | |
| D. | 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
分析 属于原电池反应,说明符合原电池的构成条件,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,以此解答.
解答 解:A.铁表面镀铜,表面有划损时,形成原电池装置,金属铁是负极,铜是正极,加快了金属铁的腐蚀,铁表面镀铜,表面有划损时,也能阻止铁被氧化不属于原电池原理,故A错误;
B.铝是亲氧元素,在空气中,铝极易和氧气反应生成氧化物薄膜,该反应中没有两个活泼性不同的电极,不能构成原电池,所以发生的不是原电池反应,故B错误;
C.铁丝与浓硫酸在常温下钝化,是因为二者之间的反应生成了致密的氧化物薄膜的保护作用,即“钝化”,不属于原电池反应,故C错误;
D.铁置换出铜,Fe、Cu、稀硫酸构成原电池,进而加快反应速率,属于原电池反应,故D正确.
故选D.
点评 本题考查了化学腐蚀和电化学腐蚀的判断,为高频考点,侧重于学生的分析能力的考查,根据原电池构成条件来分析解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  用图装置验证化学能转化为电能 | B. |  用图装置量取15.00mL KMnO4溶液 | ||
| C. | 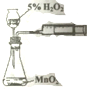 用图装置测定该化学反应速率 | D. | 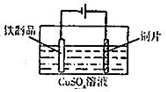 用图装置在铁制品表面镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶在使用之前要检漏 | |
| B. | 容量瓶上有温度,浓度,标线三个标识 | |
| C. | 定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出 | |
| D. | 配置好的溶液储存在容量瓶中,并贴上标签 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
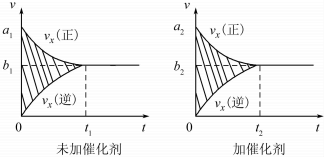
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
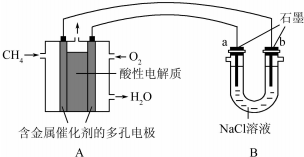
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
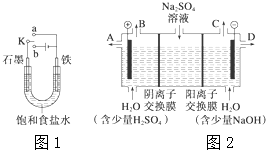 (1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

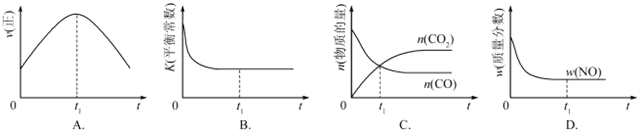
| A. | 图①表示将SO2气体通入溴水中溶液PH值随SO2气体变化关系 | |
| B. | 图②表示反应N2(g)+3H2($?_{催化剂}^{高温、高压}$g)2NH3(g)△H<0的平衡常数K随温度的变化 | |
| C. | 图③中阴、阳两极收集到的气体体积之比一定为1:1 | |
| D. | 图④中的△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com