
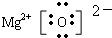 ;
;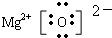 ;离子晶体;
;离子晶体; ,铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6,
,铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6, ;[Ar]3d6;
;[Ar]3d6;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、64g SO2含有氧原子数为NA |
| B、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
| C、标准状况下,22.4L CCl4的分子数为NA |
| D、常温常压下,14g N2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 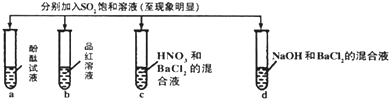 | ||||
| 记录 | 选项 | 试管a中 | 试管b中 | 试管c中 | 试管d中 |
| A | 无色 | 无色 | 无现象 | 无色溶液 | |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素原子 | 性质和结构特点 |
| A | 原子中没有成对电子 |
| B | 基态原子中成对的电子的对数与单个电子的数目相同 |
| C | 基态原子的价电子排布式为(n+1)sn(n+1)pn+1 |
| D | C、D位于同周期的相邻元素,电负性:D大于C |
| E | E处于元素周期表的第8列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤 |
| B、不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液 |
| C、制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 |
| D、某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定含有大量CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com