
| A. | 仅用新制氢氧化铜悬浊液(可以加热)不能通过化学方法完成对葡萄糖溶液、乙醇和乙酸溶液的鉴别 | |
| B. | 利用加碳酸钠饱和溶液和分液的方法可以除去乙酸乙酯中的乙酸和乙醇 | |
| C. | CH3CH2CH2OH和CH3CH2CH2Cl的同分异构体数目相同 | |
| D. | 石油的分馏、裂化,煤的干馏,都是通过化学变化获得新物质的工业生产方法 |
分析 A.葡萄糖溶液、乙醇和乙酸溶液分别与新制氢氧化铜悬浊液混合的现象为:砖红色沉淀、无现象、蓝色溶液;
B.饱和碳酸钠溶液吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
C.CH3CH2CH2OH的同分异构体有醇、醚等;
D.石油的分馏与混合物沸点有关,无新物质生成.
解答 解:A.葡萄糖溶液、乙醇和乙酸溶液分别与新制氢氧化铜悬浊液混合的现象为:砖红色沉淀、无现象、蓝色溶液,现象不同,可鉴别,故A错误;
B.饱和碳酸钠溶液吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,与乙酸乙酯分层后,分液可除杂,故B正确;
C.CH3CH2CH2OH的同分异构体有醇、醚等,若只有醇时与CH3CH2CH2Cl的同分异构体数目相同,故C错误;
D.石油的分馏与混合物沸点有关,无新物质生成,为物理变化,而石油的裂化、煤的干馏都是通过化学变化获得新物质的工业生产方法,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用及同分异构体判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蒸发时应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,将待过滤的物质沿玻璃棒倒入过滤器时,玻璃棒下端应靠在三层滤纸处 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,温度计应插入在溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 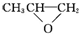 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物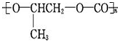 ,该反应符合绿色化学原则 ,该反应符合绿色化学原则 | |
| B. | 正丁烷的二氯代物有5种(不考虑立体异构) | |
| C. | 乙醇在铜催化下加热可脱氢生成乙醛,该反应属于氧化反应 | |
| D. | 淀粉、纤维素、麦芽糖均属于糖类,在一定条件下都可以水解得到葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将钠块投入到硫酸铜溶液中,可析出单质铜 | |
| B. | 将钠块长时间暴露在空气中的最终产物是Na2CO3 | |
| C. | Na2O与Na2O2阴阳离子个数比相同 | |
| D. | Na2O2能使品红溶液褪色且原理与SO2相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验. .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1molSO3的气体体积为22.4L | |
| B. | 1mol铁粉与过量Cl2反应时,转移电子数为2NA | |
| C. | 含有2NA个氧原子的D2O质量为40g | |
| D. | 16gO2分子中含有的氧原子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com