
| A. | 金属钠着火时可用水扑灭 | |
| B. | 中秋月饼包装盒内常放入小袋生石灰作为干燥剂 | |
| C. | 铜质水龙头与铁质水管连接处容易发生电化学腐蚀导致生锈 | |
| D. | 盐碱地(含较多的NaCl、Na2CO3等)中施加适量石膏可降低土壤的碱性 |
分析 A、钠与水反应生成氢气,氢气能燃烧,且钠燃烧生成的过氧化钠与水反应生成氧气;
B、生石灰是干燥剂,能吸水;
C、依据铁比铜活泼回答;
D、Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠.
解答 解:A、钠与水反应生成氢气,氢气能燃烧,且钠燃烧生成的过氧化钠与水反应生成氧气,所以不可用水将其扑灭,故A错误;
B、生石灰能吸水,常用作干燥剂,故B正确;
C、钢质水管与铜质水龙头连接后形成原电池,铁比铜活泼,则钢质水管做负极被腐蚀,故C正确;
D、石膏是主要成分是CaSO4,Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠,硫酸根离子和钠离子不水解,则其溶液呈中性,所以石膏能降低其碱性,故D正确,
故选A.
点评 本题主要考查的是与化学有关的生活知识,属于记忆的内容,了解常见化学物质的性质是解决本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H9Cl的物质一共有4种结构 | |
| B. | 可以用酸性KMnO4溶液除去甲烷中的乙烯 | |
| C. | 2,2-二甲基丙烷中所有碳原子在同一平面上 | |
| D. | CH3-CH=CH-CH3与HCl发生加成反应,产物有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 温度对Na2S2O3与H2SO4反应速率的影响 | ①热水浴②冷水浴 |
| B | 用Na块检验乙醇分子存在不同与烃分子里的氢原子 | ①乙醇②煤油 |
| C | 用酸化的AgNO3溶液检验来自水中Cl-能否蒸馏除去 | ①自来水②蒸馏水 |
| D | 用溴水检验苯的同系物种取代基对苯活性有影响 | ①苯②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
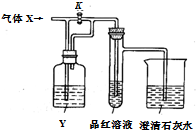 如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )
如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )| 选项 物质 | A | B | C | D |
| X | H2S | SO2 | CO2 | Cl2 |
| Y | 浓硫酸 | NaHCO3饱和溶液 | Na2SO3 溶液 | NaHSO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42- | |
| B. | c(OH-)=1×10-13 mol•L-1的溶液:Na+、K+、ClO-、SO42- | |
| C. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | B中含有的官能团为羟基 | B. | 可用碳酸钠溶液区别B、D | ||
| C. | D中含有C═O键,E的名称为乙酸乙酯 | D. | B+D→E反应的装置如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com