

| 物质 | 0℃ | 40℃ | 80℃ |
| KCl | 28.0 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38.0 |
| K2Cr2O7 | 4.7 | 26.3 | 73.0 |
| Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
| ||
| ||


科目:高中化学 来源: 题型:
 某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见如图).分析图象得到的以下结论中,一定正确的是( )
某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见如图).分析图象得到的以下结论中,一定正确的是( )| A、金属甲比金属乙活泼 |
| B、金属甲比金属乙的相对原子质量大 |
| C、金属乙比金属甲与盐酸的反应速率大 |
| D、金属乙比金属甲的化合价高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
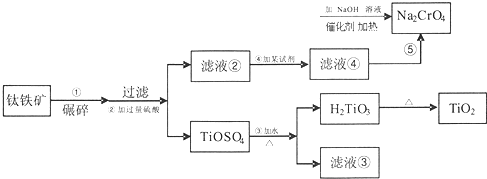
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=0.3 |
| B、x<0.3 |
| C、0.3<x<0.6 |
| D、以上结论都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
| A、①② | B、②③ | C、①②④ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com