
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从___(填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O=2Fe(OH)2。反应结束时,电池的负极的质量___(“减小”“不变”或“增加”),该电池的正极反应式为___。
(3)有如图装置:
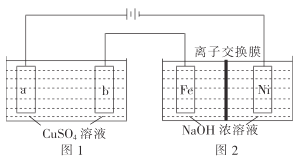
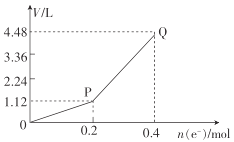
①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为___;Q点时,a电极收集到的气体体积为___。
②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___。
【答案】水表流向接头 增加 O2+4e-+2H2O=4OH- 先有红色物质析出,后有气泡产生 2.24L Fe-6e-+8OH-=FeO42-+4H2O
【解析】
(1)铁、铜、水溶液构成原电池,铁较活泼,失去电子,作负极,Cu作正极,电流方向由正极流向负极;
(3)①根据图示,同样是转移0.2mol电子,生成的气体体积不同,说明电极反应不同,开始是电解CuSO4和水,之后只有电解水。
(1)铁、铜、水溶液构成原电池,铁较活泼,失去电子,作负极,Cu作正极,电流方向由正极流向负极,电流方向为;水表流向接头;
(2)根据电池反应的,Fe失去电子化合价升高,作负极,转化为Fe(OH)2,则负极的质量增加;根据电池反应的产物Fe(OH)2,说明电解质溶液是中性或者碱性,O2在正极得到电子,与反应生成OH-,电极方程式为O2+4e-+2H2O=4OH-;
(3)①根据图示,OP阶段转移0.2mol电子,生成1.12L气体,而PQ阶段,转移0.2mol电子,生成3.36L气体,转移相同的电子,但是气体体积不同,说明两个阶段的电极反应不同。OP段,与电源正极相连的a电极,溶液中的OH-放电,电极方程式为2H2O-4e-=O2↑+4H+,转移了0.2mol电子,收集到1.12LO2;阴极,Cu2+放电,Cu2++2e-=Cu。PQ段,a电极上,依然是OH-放电,而b电极上,是H+放电,电极方程式为2H++2e-=H2↑,同样转移0.2mol电子,a电极上生成1.12LO2,而b电极上生成2.24LH2。电解过程中转移n(e-)=0.4mol,b电极上开始有铜生成,后有气体生成,实验现象为先有红色物质析出,后有气泡产生;a电极上总产生O2的体积为2.24L;
②图2中,装置通电后,溶液仍然保持澄清,铁电极生成FeO42-,Fe电极上发生的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。


科目:高中化学 来源: 题型:
【题目】某草药中有一种色素,它的结没食子儿茶素的结构简式如图,它是目前尚不能人工合成的纯天然、高效能的抗氧化剂.下列关于该物质的叙述正确的是( )
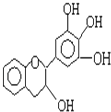
A.分子式为C15H12O5
B.1 mol 该物质与4mol NaOH恰好完全反应
C.该物质在浓硫酸作用下可发生消去反应
D.该物质可以和溴水发生取代反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
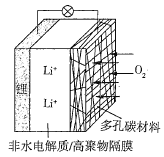
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.放电时,电解质溶液中Li+向锂电极迁移
D.放电时,电池总反应为2Li+(1-![]() )O2=Li2O2-x
)O2=Li2O2-x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,向装有5mL0.005mol.L-1FeCl3溶液的试管中加入5mL0.01mol·L-1KSCN溶液,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
A.升高温度,逆反应速率减小
B.加入Fe2(SO4)3固体,溶液血红色加深
C.加入KCl固体,溶液血红色加深
D.增大压强,溶液血红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸钠(Na2HPO3)溶液电渗析法制备H3PO3(亚磷酸)的原理如图所示,下列有关说法不正确的是( )
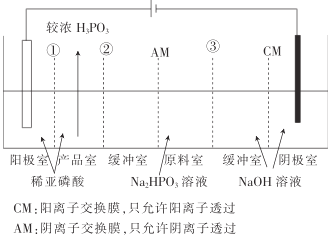
A.膜①、②、③均为CM
B.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
C.阳极的电极反应式为2H2O-4e-=4H++O2↑
D.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是重要的化工原料,工业上利用废铁屑(含少量氧化铝、 氧化铁等)生产碱式硫酸铁的工艺流程如下:
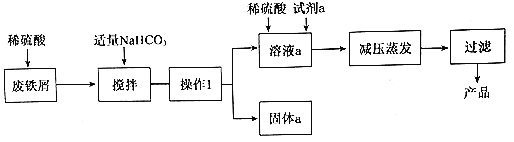
已知:Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17 Ksp[Al(OH)3]=8×10-32(单位略)
(1)工业生产中,常将废铁块处理为废铁屑,其目的是_______;用稀硫酸处理废铁屑的过程中______个氧化还原反应发生。
(2)加入碳酸氢钠后,发生反应的主要离子方程式为_______。
(3)若要使沉淀完全(一般认为离子浓度小于10-5 molL-1即为沉淀完全),溶液的pH为________;此溶液中亚铁离子的物质的量浓度不高于_____molL-1才不会生成沉淀。
(4)从环保、产品纯度角度分析.试剂a最好选择下列物质中的_____(填字母代号)。
A NaClO B KNO3 C H2O2 D KMnO4
(5)若搅拌过程中NaHCO3过量,会产生FeCO3沉淀和大量气泡,若将NaHCO3改为 Na2CO3过量时产生的沉淀为FeCO3和Fe(OH)2的混合物,试解释混合物中有Fe(OH)2的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列说法正确的是
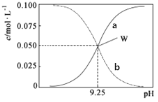
A.W点溶液中:c(H+)=c(OH-)
B.pH=8时溶液中:c(C1-)+c(OH-)=c(H+)+c(NH4+)
C.室温时NH3·H2O的电离平衡常数的值为10-9.25
D.pH=10溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
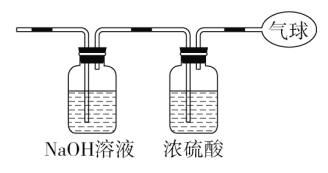
(1)该混合气体的平均摩尔质量:_________________________。
(2)混合气体中碳原子的个数:_________________________
(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:_______________________;
②标况下气球中收集到的气体的体积为___________________;
③气球中收集到的气体的电子总数为_____________________
(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物![]() 和
和![]() 的说法正确的是( )
的说法正确的是( )
A.二者的一氯代物均有6种B.二者均能发生取代反应、加成反应和氧化反应
C.二者可用酸性高锰酸钾溶液区分D.![]() 分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com