
【题目】普通电解精炼铜的方法所制备的铜中仍含杂质,利用如图中的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是( )
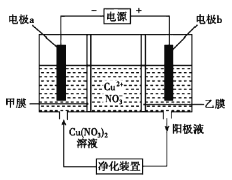
A.电极a为粗铜
B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区
D.当电路中通过1mol电子时,可生成32g精铜
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A具有如下性质:①在浓硫酸作用下,能脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;②在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;③在浓硫酸作用下,A能生成一种分子式为
的有机物A具有如下性质:①在浓硫酸作用下,能脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;②在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;③在浓硫酸作用下,A能生成一种分子式为![]() 的五元环状化合物E。下列叙述正确的是( )
的五元环状化合物E。下列叙述正确的是( )
A.A的结构简式为![]() B.A的结构简式为
B.A的结构简式为![]()
C.A转化为B的反应属于取代反应D.B与E互为同系物,C与D互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)铜原子有 _____种不同运动状态的电子,亚铜离子的价电子排布式为:_____。
(2)铜能与类卤素(CN)2 反应生成 Cu(CN)2,1 mol (CN)2 分子中含有π键的数目为____,C、N 两元素可形成的离子 CN-,该离子的结构式为_____,请写出 CN-的一种等电子体_____(写化学式)。
(3)CuCl2 溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2 ]2+(En 是乙二胺的简写),结构如图所示
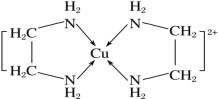
已知配合物的中心粒子的配位数指配位原子总数,则 Cu2+的配位数为_________, 该配离子中所含的非金属元素的电负性由小到大的顺序是_____;乙二胺分子中氮原子轨道的杂化类型为____,乙二胺(En)和三甲胺 [N(CH3)3 ]均属于胺类,相对分子质量相近,但乙二胺的沸点却比三甲胺的沸点高得多,其原因是:_____。
(4)某 M 原子的外围电子排布式为 3s23p5,铜与 M 形成化合物的晶胞如图所示
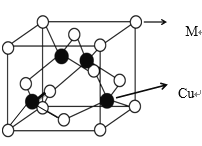
①已知铜和 M 的电负性分别为 1.9 和 3.0,则铜与 M 形成的该种化合物属于__________(填“离子”或“共价”)化合物,其化学式为__________。
②铜和形成的晶体中每个 M 原子周围最近等距的铜原子数目为_____。
③已知该晶体的晶胞参数(即立方体晶胞的棱长)为 acm,则该晶体中两个相距最近的 M 原子之间的核间距为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应速率和化学平衡、溶液pH影响的图像,其中图像和实验结论表达均正确的是

A.①是其他条件一定时,反应速率随温度变化的图像,正反应△H<0
B.②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是表示Cl2通入H2S溶液中pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池的一种回收利用工艺流程如图所示:
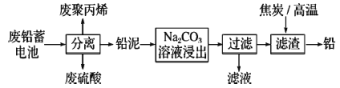
部分难溶电解质的性质如下表:

请回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有___(写一条)。
(2)利用废铅蓄电池中的废硫酸与氟磷灰石[Ca5(PO4)3F]反应,可以制化肥-过磷酸钙[有效成分是Ca(H2PO4)2],写出该反应的化学方程式:___。
(3)Na2CO3溶液浸出时发生的反应为CO32-(aq)十PbSO4(s)![]() PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=___。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程:___。
PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=___。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程:___。
(4)利用铅泥中PbSO4制取PbO2的方法:PbSO4溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb与KClO在强碱性条件下反应制取PbO2,写出生成PbO2的离子方程式:___。
(5)已知Pb(OH)2是既能溶于稀硝酸又能溶于KOH溶液的两性氢氧化物。设计实验区别PbCrO4和BaCrO4:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图1是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。请写出NO2和CO反应的热化学方程式:________________。
(2)观察图a和图b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系。图a:________________________;图b:_________________________。
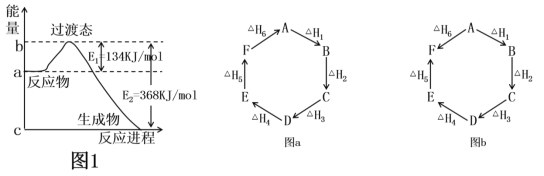
(3)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:① H2O(l)=H2O(g) △H=+44 kJ/mol
② 2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) △H= +1160 kJ/mol
③ CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ/mol
请写出CH4(g)与NO2(g)反应生成参与大气循环的气体和液态水的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备的乙酸乙酯中含有乙酸、乙醇等杂质,如图所示是提纯乙酸乙酯的操作流程,下列有关叙述正确的是( )
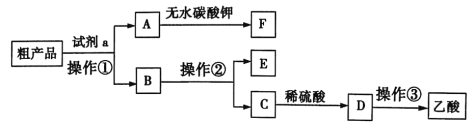
A.试剂a为NaOH溶液B.操作①为萃取
C.操作②和③均为蒸馏D.无水碳酸钾的主要作用是除去乙酸乙酯中的乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是

A. T1>T2,p1>p2,m+n>r,正反应吸热
B. T1<T2,p1<p2,m+n<r,正反应吸热
C. T1>T2,p1>p2,m+n<r,正反应放热
D. T1<T2,p1<p2,m+n>r,正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B. 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. AgCl悬浊液中存在平衡: AgCl(s) ![]() Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com