
| m-n | 0 | 1 | 2 | 3 |
| 含氧酸强度 | 弱 酸 | 中 强 | 强 | 很 强 |
| 实 例 | HClO | H3PO4 | HNO3 | HClO4 |
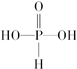 、
、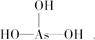 ;
; 、
、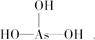 ;
;


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
| A、9g D2O中含有的电子数为5NA |
| B、92g NO2和N2O4混合气体中含有原子数为6NA |
| C、1mol C3H8分子中共价键总数为8NA |
| D、65g Zn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答:
某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离产生的c(H+)=1×10-12mol/L的溶液中:AlO2-、S2-、PO43-、Na+ |
| B、加入金属镁能产生H2的溶液中:Na+、HCO3-、SO42-、Al3+ |
| C、能使Al溶解产生H2的溶液中:NH4+、Na+、SiO32-、CO32- |
| D、含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com