
【题目】H、C、N、C、Na、S、Fe是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)Fe元素在元素周期表中的位置:___________________;
(2) 写出(CN)2的电子式: __________________;
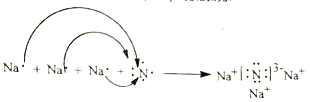
(3)用电子式表示Na3N 的形成过程: __________________;
(4)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氨氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
现有NO 与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH 溶液中,恰好完全吸收,测得溶液中含有NO3-0.02 mol,混合气体中v(NO): v(NO2)=_________;
(5) 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe3+、Fe2+等粒子物质的量随n(Cl2)/n(FeI2 )的变化可用下图简单表示
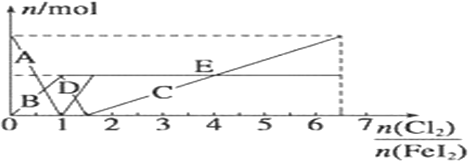
当n(Cl2)/n(FeI2 )=6.5 时,溶液中n(Cl-):n(IO3-)=_________;
【答案】 第四周期,第VIII族 ![]()
 3:7或3/7 13:2或6.5
3:7或3/7 13:2或6.5
【解析】(1)Fe元素的原子序数是26,在元素周期表中的位置是第四周期、第VIII族;(2)(CN)2是共价化合物,依据8电子稳定结构可知电子式为![]() ;(3)Na3N是离子化合物,用电子式表示Na3N的形成过程为
;(3)Na3N是离子化合物,用电子式表示Na3N的形成过程为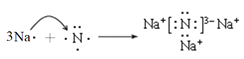 ;(4)设混合气体中含有xmolNO,ymolNO2,则
;(4)设混合气体中含有xmolNO,ymolNO2,则
NO2+NO+2NaOH=2NaNO2+H2O
1 1 2
x x 2x
2NO2+2NaOH=NaNO2+NaNO3+H2O
2 2 1
(y-x) (y-x) (y-x)/2
则2x+(y-x)=0.1、(y-x)/2=0.02,解得:x=0.03、y=0.07,所以x:y=3:7;(5)还原性强弱顺序为:I->Fe2+>I2,则在不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO3-+12H++10Cl-;可见当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氯气和碘化亚铁恰好反应,反应方程式为13Cl2+2FeI2+12H2O=2FeCl3+4HIO3+20HCl,则溶液中n(Cl-):n(IO3-)=26:4=13:2=6.5。


科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
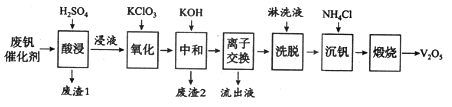
回答下列问题:
(1)五氧化二钒是一种催化剂,可将SO2转化为SO3,请写出该反应的化学方程式____________。
(2)“酸浸”时V2O5转化为VO2+,反应的离子方程式为_________________________,同时V2O4转成VO2+。“废渣1”的主要成分是_____________。
(3)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(4)“中和”作用之一是使钒以V4O124—形式存在于溶液中。“废渣2”中含有_______。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,工艺流程如下 :
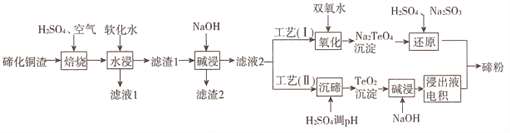
(1)“焙烧”后,碲主要以TeO2 形式存在,写出相应反应的化学方程式:_____________。
(2)为了选择最佳的焙烧工艺,进行了温度和硫酸加入量的条件试验,结果如下表所示:
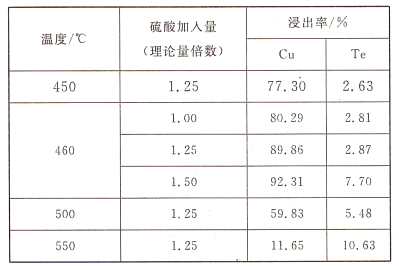
则实验中应选择的条件为_______________,原因为_______________。
(3)工艺( I)中,“还原”时发生的总的化学方程式为_______________。
(4)由于工艺(I)中“氧化”对溶液和物料条件要求高,有研究者采用工艺(II)获得碲。则“电积”过程中,阴极的电极反应式为_______________。
(5)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3 与滤液1合并,进入铜电积系统。该处理措施的优点为________________。
②滤渣3中若含Au和Ag,可用__________将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 分散质微粒直径的大小关系:溶液>胶体>浊液
B. 利用丁达尔效应可以区别溶液与胶体
C. 胶体粒子比较小,可以通过半透膜
D. 电泳现象可证明胶体属于电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是四种中学化学中常见的物质,其转化关系如图所示。则甲和丁不可能是
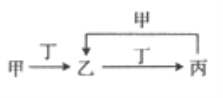
A. N2和O2 B. Cl2和Fe C. C和O2 D. SO2和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Mg(NO3)2和Al(NO3)3的混合溶液中,NO3﹣的物质的量为0.7mol.向该溶液中加入100mL 8molL﹣1的KOH溶液,使之充分反应,反应前,若Al3+的物质的量与混合溶液中离子总物质的量的比值为x. (不考虑Mg2+和Al3+的水解及水的电离所引起的离子总数的变化)
(1)x的取值范围是 .
(2)当KOH刚好完全消耗,且Al3+全部转化为AlO2﹣时,x的取值范围 .
(3)将(2)中的x值记为x1 , 则: 当0<x<x1时,反应生成的沉淀物的化学式为 .
当x>x1时反应生成的沉淀物的化学式为
(4)若反应前Al3+的物质的量为a mol,则a=(用含x的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( ) 
A.Be、Na、Al
B.B,Mg、Si
C.O,P,Cl
D.C,Al、P
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com