
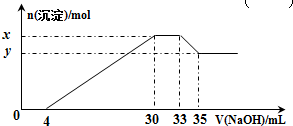
| A. | x与y的差值为0.1 mol | B. | 原溶液中c(Cl-)=0.75 mol•L-1 | ||
| C. | 原溶液的pH=1 | D. | 原溶液中n(Mg2+):n(Al3+)=5:2 |
分析 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×5mol/L}{0.2L}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则C(NH4+)=$\frac{(0.033-0.03)L×5mol/L}{0.2L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Mg2+)=$\frac{\frac{0.02L×5mol/L}{2}}{0.2L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×5mol/L}{0.2L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,据此分析解答.
解答 解:在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×5mol/L}{0.2L}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则C(NH4+)=$\frac{(0.033-0.03)L×5mol/L}{0.2L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Mg2+)=$\frac{\frac{0.02L×5mol/L}{2}}{0.2L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×5mol/L}{0.2L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,
A.x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.05mol/L×0.2L=0.01mol,故A错误;
B.原来溶液中c(Cl-)=0.825mol/L,故B错误;
C.通过分析知,c(H+)=$\frac{0.004L×5mol/L}{0.2L}$=0.1mol/L,原溶液的pH=1,故C正确;
D.通过以上分析知,c(Mg2+)=0.25mol/L,c(Al3+)=0.05mol/L,同一溶液中体积相等,其物质的量之比等于物质的量浓度之比=0.25mol/L:0.05mol/L=5:1,故D错误;
故选C.
点评 本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,知道铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,结合电荷守恒解答,题目难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 容量瓶内有少量水 | |
| D. | 用敞口容器称量NaOH且时间过长 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,甲、丙中气体密度分别为ρ1、ρ2,则ρ2>2ρ1 | |
| D. | 平衡时,SO2的转化率:α1<80%<α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
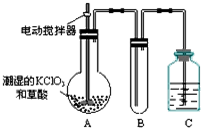 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
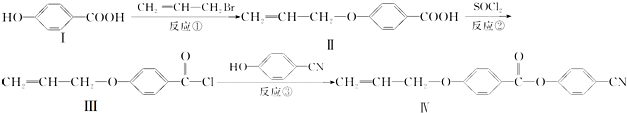
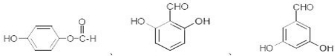 .
.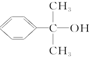 也可与化合物Ⅲ发生类
也可与化合物Ⅲ发生类 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: | |
| B. | 氮气的结构式::N≡N: | |
| C. | 氯化氢分子的形成过程可用电子式表示式: | |
| D. | 重水的化学式为 21H2O(或D2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的催化重整和煤的干馏均可以得到芳香烃,说明石油和煤中含有芳香烃 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏得到的产物可用来萃取溴水中的溴 | |
| D. | 石油裂化主要得到的是乙烯、丙烯等气态烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com