
【题目】某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:
实验(一): 热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末。
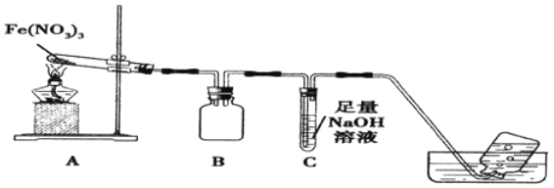
(1)B装置的作用____________;要检验A中红色固体是否为Fe2O3,应该选用的试剂是____________(填化学式)。
(2)加热A中试管一段时间后,C 中导管口有气泡产生,而集气瓶中无气泡产生原因是______________。
(3)写出硝酸铁受热分解的化学方程式__________________。
实验(二):氧化性
Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计如下实验:
试验编号 | 实验操作 | 现象 |
a | 向10mL3mol·L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
b | 向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
c | 向10 mL3mol·L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(4)设计实验a的目的是_____________________;实验c的结论是_____________________________。
(5)实验b涉及反应的离子方程式为____________________________________。
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的_____________________有关。
【答案】 防倒吸 HCl、KSCN NO2、O2恰好与氢氧化钠溶液完全反应 4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2↑ 排除NO3-的干扰 Fe3+能氧化Ag Ag++Fe2+=Fe3++Ag 浓度
2Fe2O3+12NO2↑+3O2↑ 排除NO3-的干扰 Fe3+能氧化Ag Ag++Fe2+=Fe3++Ag 浓度
【解析】(1)B装置中两个导管刚刚露出胶塞,所以B装置起到防止倒吸的作用;要检验A中红色固体是否为Fe2O3,需要将残留固体溶于水,过滤,取滤渣溶解于HCl或者稀H2SO4,因为Fe2O3与H+反应生成Fe3+,再用KSCN试剂检验Fe3+的存在,若溶液变成血红色,红色固体是Fe2O3,所以需要的试剂是盐酸或者稀硫酸与KSCN溶液;
(2)加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末,发生反应的方程式:4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2 ↑,4NO2+O2 +4NaOH=4NaNO3+2H2O,NO2与O2的混合气体恰好被NaOH溶液吸收,所以C 中导管口有气泡产生,产生的气泡被NaOH吸收,集气瓶中自然就无气泡产生了,所以正确答案是:NO2、O2恰好与氢氧化钠溶液完全反应;
2Fe2O3+12NO2↑+3O2 ↑,4NO2+O2 +4NaOH=4NaNO3+2H2O,NO2与O2的混合气体恰好被NaOH溶液吸收,所以C 中导管口有气泡产生,产生的气泡被NaOH吸收,集气瓶中自然就无气泡产生了,所以正确答案是:NO2、O2恰好与氢氧化钠溶液完全反应;
(3)根据(2)的解析可知:硝酸铁受热分解的化学方程式4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2 ↑;
2Fe2O3+12NO2↑+3O2 ↑;
(4)利用a实验验证NO3-离子在酸性条件下能否将Ag氧化为Ag+,根据实验现象,说明在pH=1的情况下,NO3-离子不能够将Ag氧化,排除了NO3-离子对后续实验的干扰作用,正确答案:排除NO3-的干扰;根据c实验的现象可知:Fe3++Ag=Fe2++Ag+,Ag++Cl-=AgCl↓,说明Fe3+能氧化Ag;
(5)向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 紫红色溶液不褪色,说明溶液中已经没有Fe2+,Fe2+已经被溶液中的Ag+离子氧化了,即:Fe2+ +Ag+=Fe3+ Ag,所以b涉及反应的离子方程式是:Fe2+ +Ag+=Fe3+ +Ag;
(6)对照实验b中Ag+浓度大,可以将Fe2+氧化,c中Fe3+离子浓度大,可以将Ag氧化,因此,Fe3+、Ag+氧化性的相对强弱与溶液中两种离子的浓度有关。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】ag 硝酸钾溶于bg水,形成VmL饱和溶液。下列关系式错误的是( )
A. 该溶液的物质的量浓度:c(KNO3)=![]() mol·L-1
mol·L-1
B. 该溶液的质量分数:w(KNO3)=![]() %
%
C. 20 ℃时KNO3的溶解度S=![]() g
g
D. 该溶液的密度ρ=![]() g·L-1
g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉
B. CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
C. 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),压缩体积,平衡正向移动,K值增大
PCl5(g),压缩体积,平衡正向移动,K值增大
D. 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
B. 用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠,溶液中可观察到有大量白色沉淀产生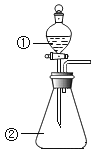
C. Na2O2在空气中久置变白,涉及的氧化还原反应中,Na2O2是还原剂H2O是氧化剂
D. 向明矾溶液里滴加Ba(OH)2溶液,当SO42-恰好完全沉淀时,铝元素几乎全部以AlO2—形式存在于溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图为: | |
| 有机物X的相对分子质量是________。 |
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 | 有机物X的分子式是______。 |
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。 | 有机物X的结构简式是__________。 |
II.写出与![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 在标准状况下,2.24LSO3中含氧原子数为0.3NA
B. 1L0.1mol/L(NH4)2Fe(SO4)2溶液中,阳离子总数为0.3NA
C. 常温常压下,4.2g乙烯和环丙烷的混合气体中所含原子总数为0.9NA
D. 将0.1molCl2通入足量热的浓NaOH溶液中完全反应生成NaCl、NaClO3和水,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。加入Na2O2的量与生成白色沉淀的量之间的关系用图来表示。
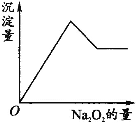
试推断:
(1)原溶液中一定含有________。
(2)一定不含有________。
(3)可能含有________。
(4)为了进一步确定可能含有的离子,应增加的实验方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:

已知:M的结构简式为: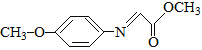 。
。
请回答下列问题:
(1)A的化学名称是_______________,B的化学式是________________。
(2)C中官能团的名称是__________________________。
(3)写出F的结构简式__________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:______________________________。
(5)满足下列条件的M的同分异构体有_______种(不含立体异构)。
① 能够发生银镜反应。
② 含有硝基(–NO2),且硝基直接连在苯环上。
③ 含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为________(写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是( )
A. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以加快该反应的速率.
B. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C. 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol/L
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com