
| A. | 44g乙醛与乙酸乙酯的混合物中含氧原子数为NA | |
| B. | 40gH2${\;}_{\;}^{18}$O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 62gNa2O与78gNa2O2所含的阴离子数均为NA |
分析 A.乙醛和乙酸乙酯的最简式都是C2H4O,根据最简式计算出二者的混合物中含有的氧原子数目;
B.质量转化为物质的量,结合H2${\;}_{\;}^{18}$O含有10个中子,D2O含有10个中子解答;
C.铁与稀硫酸反应生成二价铁,与稀硝酸反应生成三价铁;
D.质量转化为物质的量结合过氧化钠阴离子为过氧根离子解答.
解答 解:A.44g乙醛和乙酸乙酯的混合物中含有1mol最简式C2H4O,含有1mol碳原子,含有的碳原子数目为NA,故A正确;
B.H2${\;}_{\;}^{18}$O含有10个中子,D2O含有10个中子,H2${\;}_{\;}^{18}$O与D2O摩尔质量相等都是20g/mol,40gH2${\;}_{\;}^{18}$O与40gD2O物质的量为$\frac{40g}{20g/mol}$=2mol,含有中子数为20NA,故B正确;
C.1molFe与足量的稀硫酸反应生成1mol硫酸亚铁,转移2NA电子,与足量稀硝酸反应生成1mol硝酸铁,转移电子数均为3NA,故C错误;
D.62gNa2O物质的量为$\frac{62g}{62g/mol}$=1mol,含有1mol氧离子,78gNa2O2物质的量为$\frac{78g}{78g/mol}$=1mol,含的阴离子过氧根离子数均为1mol,故D正确;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意过氧化钠中阴离子为过氧根离子,题目难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | H2SO4+2NaOH═Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①不变浑浊,②变浑浊 | B. | ①变浑浊,②不变浑浊 | ||
| C. | ①变浑浊,②变浑浊 | D. | ①不变浑浊,②变浅黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
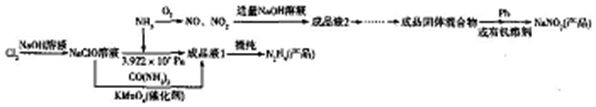
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


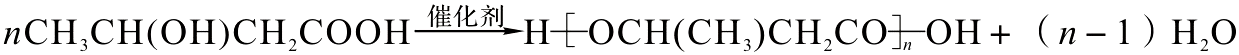 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸、BaCl2溶液 | B. | 稀硝酸、BaCl2溶液 | ||
| C. | Ba(NO3)2溶液、稀盐酸 | D. | BaCl2溶液、稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com