
【题目】下图装置可作集气瓶和洗气瓶。现有以下5种气体:①Cl2②NH3③NO④NO2⑤SO2 (作答请填序号)。
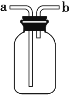
(1)若集气瓶是干燥的,则由b口进气可收集的气体有______。
(2)若集气瓶充满水,可收集的气体有_______;此时气体由______口进入。
(3)若集气瓶内装入浓硫酸进行气体干燥,不能用此装置干燥的气体是____。若干燥时气体由____口进入。
【答案】② ③ b ② a
【解析】
(1)若烧瓶是干燥的,则由b口进气a口出气,说明收集气体的密度小于空气,且常温下和空气中氧气不反应;
(2)若烧瓶充满水,可收集的气体应不溶于水,且与水不反应;
(3)干燥气体时,气体应从长导管进,短导管出,且气体与浓硫酸不反应。
(1)若由b口进气a口出气,说明收集气体的密度小于空气,且常温下和空气中氧气不反应,满足条件的气体有②NH3;
(2)若烧瓶充满水,可收集的气体应不溶于水,且与水不反应,则③NO符合,用排水法收集气体时,气体应从短导管进,即从b进;
(3)干燥气体时,气体应从长导管进,短导管出,且气体与浓硫酸不反应,题中①Cl2③NO④NO2和⑤SO2都可用浓硫酸干燥,气体应该从a口进入,但不能用此装置干燥②NH3。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某度旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如下表:

(1)滤液A的主要成分除NaOH外,还有_____________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:_______________________________________________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2
c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质.写出反应Ⅱ中CuS发生反应的化学方程式:____________________________________________。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的抗腐蚀性佳,主要用于合金和电镀,也可用作良好的催化剂。现准确称量8g粗镍(含有少量Fe、Cu以及难与酸、碱反应的杂质)进行如下提纯。
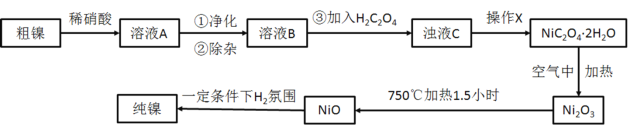
请回答下列问题:
(1)写出稀硝酸溶解镍的离子方程式___。
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节pH=5.5,继续加热煮沸5min,加热过程中补充适量的水保持溶液的体积不变,静止一段时间后,过滤出Fe2O3、FeO(OH)。
①写出煮沸过程中生成FeO(OH)的离子方程式___。
②控制溶液的pH,可利用___。
a.pH试纸 b.石蕊指示剂 c.pH计
③为了得到纯净的溶液B,还需要加入以下物质___(填字母)进行除杂。(已知:Ksp(CuS)=8.8×10-36;Ksp(NiS)=3.2×10-19;Ksp[Cu(OH)2]=2.2×10-20;Ksp[Ni(OH)2]=5.4×10-16)
a.NaOH b.Na2S C.H2S d.NH3·H2O
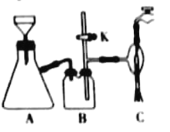
(3)在快速搅拌下缓慢向溶液B中滴加12%的H2C2O4溶液,溶液中即可析出NiC2O4·2H2O,搅拌下煮沸2min冷却。操作X包括:过滤、洗涤和烘干,采用如图的装置进行过滤(备注:该图是一个通过水泵减压过滤的装置)。这种抽滤其优点是___,装置B的主要作用是___,若实验过程中发现倒吸现象,应采取的措施是___。
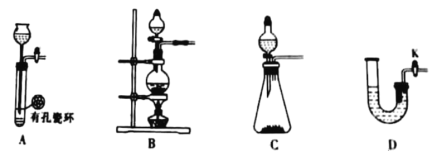
(4)在该生产过程中需要纯净的H2。若实验室要制备纯净的H2,发生装置不可以选择___(选填代号)。
(5)用电子天平称取0.5000g的NiO样品,加入一定体积的6mol/L的盐酸恰好完全溶解,将所得到的溶液配制成250mL的溶液。取出20mL加入锥形瓶,按照如下滴定原理进行沉淀滴定,最终得到干燥的固体mg,则镍元素的质量分数为___。(写出表达式即可)
[一定条件下丁二酮肟(![]() ,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y=![]() 或
或![]() ],与pH的变化关系如图所示。则下列说法一定错误的是( )
],与pH的变化关系如图所示。则下列说法一定错误的是( )
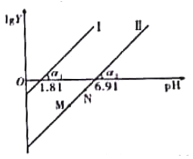
A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.当对应溶液的pH处于1.81<pH<6.91时,溶液中的微粒浓度一定存在c(HSO3-)>c(SO32-)>c(H2SO3)
D.直线Ⅱ中M、N点一定存在c2(HSO3-)>c(SO32-)·c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(In1-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]___;Ga、In、Se,第一电离能从大到小顺序为___。
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是___。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是___。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为___。
(4)SeO32-的立体构型为___;SeO2中硒原子采取杂化类型是___。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
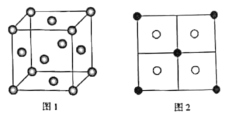
①CuS晶体中,相邻的两个铜离子间的距离为___pm。
②Cu2S晶体中,S2-的配位数为___。
③Cu2S晶体的密度为ρ=___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空。甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:

(1)若甲是不溶于水的白色固体,是刚玉的主要成分,且既能溶于硫酸又能溶于氢氧化钠溶液;乙的酸根中含有金属元素。写出下列物质间的转化: 甲![]() 乙的离子方程式___;丙
乙的离子方程式___;丙![]() 甲的化学方程式____。
甲的化学方程式____。
(2)若甲是无色气体,也是形成酸雨的物质;乙在标准状况下为无色晶体。 写出下列物质间的转化:甲![]() 乙的化学反应方程式____________;丙
乙的化学反应方程式____________;丙![]() 甲的化学反应方程式_________。
甲的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
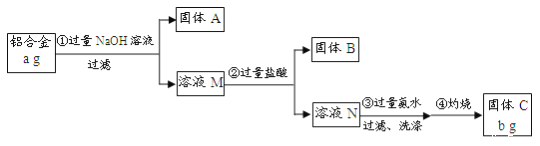
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2;2NaOH+SiO2=Na2SiO3+H2O;Na2SiO3+
2HCl=2NaCl+H2SiO3↓。
请回答下列问题:
(1)固体A的成分是_______;
(2)步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______。(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期主族元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是

A.WX的水溶液呈碱性
B.元素非金属性的顺序为:Y>Z>Q
C.由X、Y、Q、W四种元素形成的化合物的水溶液一定呈碱性
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于下图装置的说法正确的是

A. 若断开K1关闭K2,X、Y均为石墨,Z是NaCl溶液,则X 附近能得到氢氧化钠
B. 若断开K1关闭K2,X是纯铜,Y是粗铜,Z是CuSO4溶液,则该装置可用于铜的精炼
C. 若断开K2关闭K1,X是Cu,Y是Fe,Z是含有空气的海水,则该装置可用于保护Fe
D. 若断开K2关闭K1,X是Cu,Y是Zn,Z是稀H2SO4,则在X极有气泡生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com