
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
【答案】D
【解析】
放电时,Zn是负极,负极反应式为Zn-2e-═Zn2+,正极反应式为I2Br-+2e-=2I-+Br-,充电时,阳极反应式为Br-+2I--2e-=I2Br-、阴极反应式为Zn2++2e-=Zn,只有阳离子能穿过交换膜,阴离子不能穿过交换膜,据此分析解答。
A、放电时,a电极为正极,碘得电子变成碘离子,正极反应式为I2Br-+2e-=2I-+Br-,故A正确;
B、放电时,正极反应式为I2Br-+2e-=2I-+Br-,溶液中离子数目增大,故B正确;
C、充电时,b电极反应式为Zn2++2e-=Zn,每增加0.65g,转移0.02mol电子,阳极反应式为Br-+2I--2e-=I2Br-,有0.02molI-失电子被氧化,故C正确;
D、充电时,a是阳极,应与外电源的正极相连,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
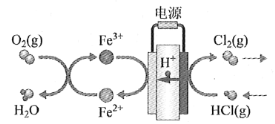
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.NaOH加入NaHCO3溶液中:OH- + HCO![]() = H2O + CO
= H2O + CO![]()
B.少量CO2通入NaOH溶液中:2OH- + CO2= CO![]() + H2O
+ H2O
C.盐酸加入NaHCO3溶液中:H+ + HCO![]() = H2O + CO2↑
= H2O + CO2↑
D.金属钠与水反应:Na + H2O = Na+ + OH- + H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________,现象为__________________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为________________________,浓硫酸也可作该反应的催化剂,选择![]() 而不用浓硫酸的原因为________________________(填序号)。
而不用浓硫酸的原因为________________________(填序号)。
a.浓硫酸易使原料碳化并产生![]()
b.![]() 污染小、可循环使用,符合绿色化学理念
污染小、可循环使用,符合绿色化学理念
c.同等条件下,用![]() 比浓硫酸的平衡转化率高
比浓硫酸的平衡转化率高
②仪器B的作用为____________。
(3)操作2用到的玻璃仪器是____________。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向![]() 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的![]() ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的![]() 与足量
与足量![]() 作用生成
作用生成![]() ,用
,用![]() 的
的![]() 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗![]() 标准溶液
标准溶液![]() (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①![]()
②![]()
③![]()
(5)滴定所用指示剂为____________。样品中环己烯的质量分数为____________(用字母表示)。
(6)下列情况会导致测定结果偏低的是____________(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.![]() 标准溶液部分被氧化
标准溶液部分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O、N四种元素,如图为该有机物的球棍模型。
(1) 该有机物的化学式________________;
该有机物的化学式________________;
(2)该物质属于________;
A.有机物 B.氨基酸 C.二肽 D.糖 E.油脂
(3)该有机物发生水解反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CH3-CH=CH-C≡C-CH3分子结构的下列叙述中,正确的是( )
A. 6个碳原子有可能都在同一直线上
B. 在同一平面上的原子至少有8个
C. 在同一直线上的原子至少有5个
D. 分子中呈四面体结构的碳原子有3个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com