
 ,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3S23P4,B是Na元素,A是O元素,Na2O2中过氧根离子和钠离子之间存在离子键,氧原子和氧原子之间存在共价键,所以过氧化钠的电子式为:
,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3S23P4,B是Na元素,A是O元素,Na2O2中过氧根离子和钠离子之间存在离子键,氧原子和氧原子之间存在共价键,所以过氧化钠的电子式为: ,O原子核外有8个电子,1s、2s、2p能级上分别含有2、2、4个电子,所以其轨道表示式为:
,O原子核外有8个电子,1s、2s、2p能级上分别含有2、2、4个电子,所以其轨道表示式为: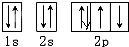 ,
, ;3S23P4;
;3S23P4; ;
; ;
;

科目:高中化学 来源: 题型:
| A、氧化铜与稀硫酸反应:CuO+2H+=Cu2++H2O |
| B、石灰石溶于醋酸溶液:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、单质铁溶于稀硝酸溶液中:2Fe+6H+=2Fe3++3H2↑ |
| D、氢氧化钡与盐酸发生中和反应:Ba(OH)2+2H+=Ba2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、HCO3-、K+、NO3- |
| B、HCO3-、H+、Ba2+、Na+ |
| C、HCO3-、OH-、Al3+、Na+ |
| D、Mg2+、Fe3+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/Mpa 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24LHCl溶于水,溶液中H+数为NA |
| B、100g98%的浓硫酸中含氧原子个数为4NA |
| C、2.3gNa和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA |
| D、1molFeCl3跟水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸滴入氨水中:H++OH-=H2O |
| B、Na2S的水解反应:S2-+2H2O=H2S↑+2OH- |
| C、在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++2HCO3-+Ca2++2OH一=MgCO3↓+CaCO3↓+2H2O |
| D、铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol/L的Fe(NO3)2溶液:H+、Na+、SCN-、S2- |
| B、c(OH-)/c(H+)=1013的溶液Mg2+、NH4+、MnO4-、Cl- |
| C、pH=l的溶液:K+、NH4+、NO3-、Cl- |
| D、能溶解Al2O3的溶液:Na+、K+、HCO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式:C2H4 | ||
B、中子数为20的钾原子:
| ||
C、次氯酸的电子式: | ||
D、CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )
根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )| A、+1533.8 |
| B、-1533.8 |
| C、+295.4 |
| D、-295.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com