
 一定温度下,甲酸加水稀释过程中溶液的导电能力如图所示曲线,请回答:
一定温度下,甲酸加水稀释过程中溶液的导电能力如图所示曲线,请回答:分析 (1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)导电能力越强,离子浓度越大,氢离子浓度越大;
(3)溶液越稀,越促进甲酸电离,酸的电离程度越大;
(4)要使甲酸根离子浓度增大,可以采用加热、加入含有甲酸根离子的物质、加入和氢离子反应的物质
解答 解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,甲酸中没有发生电离,所以甲酸不导电,
故答案为:甲酸没有电离;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,所以a、b、c三点的pH由小到大的顺序是bac,
故答案为:bac;
(3)溶液越稀,越促进甲酸电离,则溶液中酸的电离程度越大,所以甲酸的电离度最大的一点是c,
故答案为:c;
(4)要使甲酸根离子浓度增大,可以采用加热、加入含有甲酸根离子的物质、加入和氢离子反应的物质,
A.加热促进甲酸电离,则溶液中醋酸根离子浓度增大,故正确;
B.加很稀的NaOH溶液,和氢离子反应,促进醋酸电离,若氢氧化钠对甲酸根离子的影响小于溶液体积的影响,则甲酸根离子浓度会减小,故错误;
C.加NaOH固体,氢氧化钠和氢离子反应促进甲酸电离,所以甲酸根离子浓度增大,故正确;
D.加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;
E.加固体HCOONa,甲酸根离子的浓度增大,故正确;
F、加入Zn粒,消耗氢离子,促进甲酸的电离,甲酸根离子浓度增大,故正确;
故答案为:ACEF.
点评 本题考查电解质的电离,题目难度中等,易错选项是D,加水稀释甲酸,能促进甲酸电离,但溶液中甲酸根离子增大的量小于水体积增大的量,所以甲酸根离子浓度减小,为易错点.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
仅依据下表给出的物理量X和Y,其中不能求出物质的量的是
A | B | C | D | |
X | 物质中的粒子数 | 标准状况下的 气体摩尔体积 | 固体的体积 | 溶液中溶质的 物质的量浓度 |
Y | 阿伏加德罗常数 | 标准状况下 气体的体积 | 固体的密度 | 溶液体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
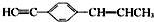 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一个平面上 | |
| B. | 最多可能有9个碳原子在同一平面上 | |
| C. | 只能有4个碳原子在同一直线上 | |
| D. | 有7个碳原子可能在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 与H2反应由易到难:F2>Cl2>Br2>I2 | D. | 还原性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质(杂质) | 试剂 | 方法 | |
| A | Cl2(HCl) | 饱和食盐水,浓硫酸 | 洗气 |
| B | 溴化钠(溴) | CCl4、水 | 萃取、分液 |
| C | 乙醇(乙酸) | NaOH溶液 | 分液 |
| D | 溴苯(溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②⑤⑥ | C. | ②⑤⑥ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com