
 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
分析 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属,A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A,则A、B、C分别是C、N、O元素;B与D同主族,则D为P元素;E为第4周期副族元素,其价层电子为全满,则为Zn元素;
(1)E为Zn元素,其原子核外3d、4s电子为其价电子;
(2)B与D分别与氢形成最简单氢化物分别是NH3和PH3,含有氢键的氢化物熔沸点高于不含氢键的氢化物;
(3)这几种氢化物中每个M原子价层电子对个数都是4,所以其杂化方式相同;排斥力:孤电子对与孤电子对>孤电子对与成键电子对>成键电子对与成键电子对,排斥力越大,形成的化学键越不稳定;
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,该阳离子应该为PCl4+,生成的阴离子为PCl6-,利用价层电子对互斥理论判断该阴离子空间构型;
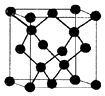
(5)该晶胞中Zn原子个数=4、O原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据原子个数比确定化学式;
该晶胞体积=(a×10-10 )3cm3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:有A、B、C、D、E五种原子序数增大的元素,只有一种为金属,A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A,则A、B、C分别是C、N、O元素;B与D同主族,则D为P元素;E为第4周期副族元素,其价层电子为全满,则为Zn元素;
(1)E为Zn元素,其原子核外3d、4s电子为其价电子,其价电子排布式为3d104s2 ,
故答案为:锌;3d104s2 ;
(2)B与D分别与氢形成最简单氢化物分别是NH3和PH3,含有氢键的氢化物熔沸点高于不含氢键的氢化物,NH3中含有氢键、PH3中不含氢键,所以熔沸点NH3>PH3,
故答案为:NH3>PH3;NH3分子间存在氢键;
(3)这几种氢化物中每个M原子价层电子对个数都是4,所以其杂化方式相同,则杂化方式为一种;排斥力:孤电子对与孤电子对>孤电子对与成键电子对>成键电子对与成键电子对,排斥力越大,形成的化学键越不稳定,乙烷中的碳原子没有孤电子对,肼中的氮原子有1对孤对电子,过氧化氢中的氧原子有两对孤对电子,孤对电子数越多斥力越大,形成的化学键越不稳定,键能越小,
故答案为:1;乙烷中的碳原子没有孤电子对,肼中的氮原子有1对孤对电子,过氧化氢中的氧原子有两对孤对电子,孤对电子数越多斥力越大,形成的化学键越不稳定,键能越小;
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,该阳离子应该为PCl4+,生成的阴离子为PCl6-,其电离方程式为2PCl5=PCl6-+PCl4+,
该阴离子中P原子价层电子对个数=6+$\frac{5+1-6×1}{2}$=6,所以为正八面体;
故答案为:2PCl5=PCl6-+PCl4+;正八面体;
(5)该晶胞中Zn原子个数=4、O原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据原子个数比确定化学式为ZnO;
该晶胞体积=(a×10-10 )3cm3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{81}{{N}_{A}}×4}{(a×1{0}^{-10})^{3}}$g/cm3=$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:ZnO;$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、微粒空间构型判断、氢键等知识点,侧重考查学生分析、计算及空间想象能力,注意(5)中单位换算,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA | |
| C. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| D. | 工业上电解饱和氯化钠溶液,得到标准状况下22.4L氢气时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
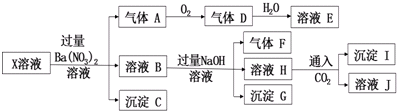
| A. | 气体A是无色有刺激性气味的有毒气体 | |
| B. | X中肯定存在Fe2+、Mg2+、NH4+、SO42- | |
| C. | 沉淀I中加入过量溶液E,沉淀完全溶解 | |
| D. | X中不能确定的阳离子只有A13+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(NaOH) | B. | NaCl(HCl) | C. | CuCl2 (CuO) | D. | H2SO4 (H2SO4 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨气化吸热,可用作制冷剂 | B. | 明矾易溶于水,可用作净水剂 | ||
| C. | 盐酸具有还原性,可用于除去铁锈 | D. | 浓硝酸其有酸性,可用于钝化铁、铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com