
| Y | |||
| M | X | Z |
| A、钠与Z可能形成Na2Z2化合物 |
| B、由X与氧组成的物质在熔融时能导电 |
| C、Y的最简单气态氢化物的热稳定性比X的强 |
| D、M的简单离子半径是同周期中简单离子半径最小的 |


科目:高中化学 来源: 题型:
| A、在标准状况下,28g的N2和CO的混合气体,其体积约为22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,1mol水的体积约为22.4L |
| D、在标准状况下,NA个任何分子所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入 | 存在Fe3+ | |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴KMnO4溶液,振荡 | 存在Fe2+ |
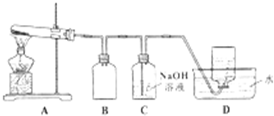
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是能提供能量的资源都是能源 |
| B、解决能源危机的有效办法包括提高能源利用率、寻找新能源等 |
| C、化石燃料不可再生、易产生污染,且储量有限,是一种有局限性的能源 |
| D、雾霾中含有大量的PM2.5可吸入颗粒,汽车尾气与雾霾的形成无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64g氧气中含氧分子数为2NA |
| B、1.7gOH-中所含的电子数为NA |
| C、49g硫酸中所含氧原子数为2NA |
| D、58.5g氯化钠中所含的离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
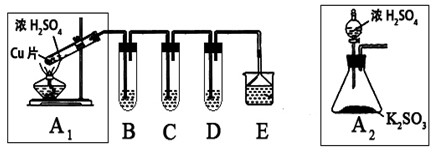
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热、加压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com