
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | Y的阳离子半径比W的阴离子半径小 | |
| C. | X、Z、W最高价氧化物对应水化物酸性的强弱顺序为X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液其pH<7 |
分析 Y元素的单质既能与盐酸反应也能与NaOH溶液反应,应为Al元素,Z原子的最外层电子数是次外层电子数的一半,应为Si元素,X与Z位于同一主族,则X为C元素,Y、Z、W原子的最外层电子数之和为14,则W的最外层电子数为14-3-4=7,且原子序数最大,应为Cl元素,结合元素周期律的递变规律判断元素对应的单质、化合物的性质.
解答 解:A.气态氢化物的稳定性应该是:Z<X<W,即Si<C<Cl,故A错误;
B.Y的阳离子半径比W的阴离子少一个电子层,离子半径较小,故B正确;
C.非金属性C>Si,则C的对应的最高价氧化物的酸性较Si的强,故C错误;
D.Y是铝元素,含铝元素的盐如AlCl3水溶液显酸性,NaAlO2水溶液显碱性,故D错误.
故选B.
点评 本题考查元素的推断及元素化合物的性质,题目难度中等,注意从物质的性质作为推断题的突破口,注意常见既能与盐酸反应也能与NaOH溶液反应的物质,题中从常见元素化合物的性质入手考查,是一道位置、结构、性质有机结合综合考查学生分析能力、推断能力的典型题目,难度较大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H4、C4H6 | B. | C2H2、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则试样中肯定不含有K+ | |
| B. | 过滤操作时,为了加快过滤可以用玻璃棒搅拌漏斗的液体 | |
| C. | 蒸馏装置中,温度计水银球的位置应该在蒸馏烧瓶的支管口附近 | |
| D. | 粗盐的提纯实验中,滤液在坩埚中加热蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
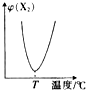
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2×10-3mol•L-1 | B. | 1.2×10-9mol•L-1 | C. | 2.4×10-5mol•L-1 | D. | 3.2×10-6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
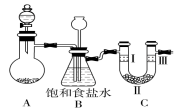 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
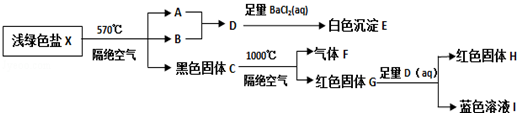

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com