
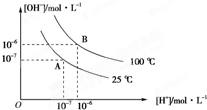
 在水的电离平衡中,[H+]和[OH-]的关系如图所示:
在水的电离平衡中,[H+]和[OH-]的关系如图所示:| 10-12 |
| 5×10-4 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
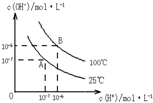 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
在水的电离平衡中,![]() 和
和![]() 的关系如下图所示:
的关系如下图所示:
(1)A点水的离子积为1×10-14,B点水的离子积为 。造成水的离子积变化的原因是 。
(2)25℃时,![]() 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:
![]() ,
,![]()
![]() 。
。
① 0.1 mol/L![]() 溶液的pH 1(填“>”、“<”或“=”)。
溶液的pH 1(填“>”、“<”或“=”)。
②在0.1 mol/L![]() 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:
。
(3)100℃时,0.01 mol/L![]() 溶液的pH = 。
溶液的pH = 。
(4)100℃时,将pH =8的![]() 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则![]() 溶液与盐酸的体积比为 。
溶液与盐酸的体积比为 。
查看答案和解析>>
科目:高中化学 来源:2010年海南省嘉积中学高二上学期第二次月考化学试卷 题型:填空题
在水的电离平衡中,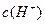 和
和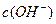 的关系如下图所示:
的关系如下图所示: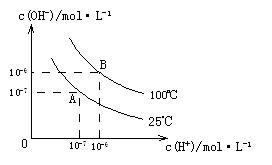
(1)A点水的离子积为1×10-14,B点水的离子积为 。造成水的离子积变化的原因是 。
(2)25℃时,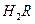 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: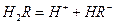 ,
,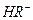

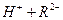 。
。
① 0.1 mol/L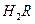 溶液的pH 1(填“>”、“<”或“=”)。
溶液的pH 1(填“>”、“<”或“=”)。
②在0.1 mol/L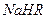 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:
。
(3)100℃时,0.01 mol/L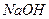 溶液的pH = 。
溶液的pH = 。
(4)100℃时,将pH =8的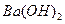 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则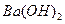 溶液与盐酸的体积比为 。
溶液与盐酸的体积比为 。
查看答案和解析>>
科目:高中化学 来源:2010年海南省高二上学期第二次月考化学试卷 题型:填空题
在水的电离平衡中,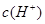 和
和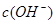 的关系如下图所示:
的关系如下图所示:
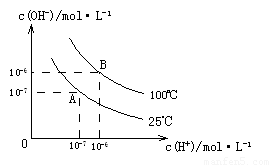
(1)A点水的离子积为1×10-14,B点水的离子积为 。造成水的离子积变化的原因是 。
(2)25℃时,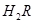 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:
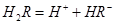 ,
,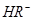
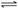
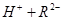 。
。
① 0.1 mol/L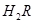 溶液的pH
1(填“>”、“<”或“=”)。
溶液的pH
1(填“>”、“<”或“=”)。
②在0.1 mol/L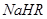 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:
。
(3)100℃时,0.01 mol/L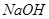 溶液的pH = 。
溶液的pH = 。
(4)100℃时,将pH =8的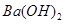 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则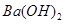 溶液与盐酸的体积比为 。
溶液与盐酸的体积比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com