


科目:高中化学 来源: 题型:
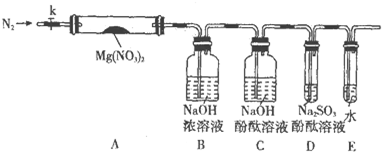 固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
| ||
| ||
| ||
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
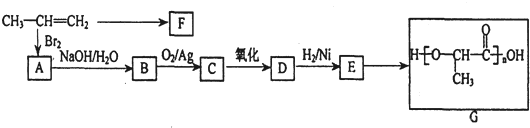
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
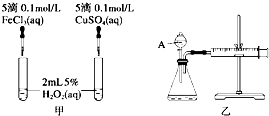 经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 浓硫酸 |
| 170℃ |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(M+)>c(OH-)>c(A-)>c(H+) |
| B、c(M+)>c(A-)>c(H+)>c(OH-) |
| C、c(M+)>c(A-)>c(OH-)>c(H+) |
| D、c(M+)>c(H+)>c(A-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com